Mariana Floria1, C. Rezuş2, Mirela Paraschiva Ciutea2, Mihaela Claudia Tudor3, V. Ambăruş2
Articol primit în data de 16 august 2011. Articol acceptat în data de 13 februarie 2012.
1 Clinica II Medicală, Spitalul Universitar de Urgenţe „Sfântul Spiridon” Iaşi
2 Clinica III Medicală, Spitalul Universitar de Urgenţe „Sfântul Spiridon” Iaşi; Universitatea de Medicină şi Farmacie „Gr. T. Popa” Iaşi
3 Institutul Clinic Fundeni, Secţia Anestezie şi Terapie Intensivă
Dr. Mariana Floria – Clinica II Medicală, Spitalul Universitar de Urgenţe „Sfântul Spiridon” Iaşi. Bd. Independenţei nr.1, Iaşi.
e-mail: floria_mariana@yahoo.com
Rezumat: Apneea obstructivă de somn este forma extremă a tulburărilor respiratorii legate de somn. Se caracterizează prin obstrucţia intermitentă, parţială sau completă, a căilor respiratorii superioare, cu oprirea respiraţiei în timpul somnului şi consecinţe cardiovasculare, pulmonare, neurologice şi metabolice. Apneea obstructivă de somn creşte morbiditatea şi mortalitatea cardiovasculară fiind recunoscută drept un factor de risc. Tulburările de ritm cardiac sunt comune la pacienţii cu apnee obstructivă de somn iar prevalenţa reală şi relevanţa lor clinică nu sunt încă pe deplin cunoscute. Articolul prezintă principalele aritmii asociate cu apneea obstructivă de somn în conformitate cu datele din literatură. În prezent se fac eforturi pentru a identifica pacienţii care răspund cel mai bine la opţiunile terapeutice actuale şi de găsire a unor noi alternative de tratament.
Cuvinte cheie: apneea de somn, aritmii cardiace
Abstract: Obstructive sleep apnea is the most extreme variant of sleep disordered breathing. This is characterized by intermittent of partial or complete obstruction of the upper airway leading to cessation of breathing while asleep and also to cardiovascular, pulmonary, neurological and metabolical consequences. There are increasing evidences that obstructive sleep apnea increases cardiovascular morbidity and mortality; being recognized as individual cardiovascular risk factor. Cardiac arrhythmias are common problems in patient with obstructive sleep apnea and the true prevalence and clinical relevance of cardiac arrhythmias remains to be determined. This article presents the arrhythmias related to the obstructive sleep apnea conforming to the literature data. Nowadays substantial research efforts are made to identify those patients who will respond most favorably to certain treatment options and to develop alternative treatment methods.
Keywords: sleep apnea, cardiac arrhythmias
INTRODUCERE
Tulburările respiratorii legate de somn includ o serie de afecţiuni caracterizate prin anomalii de frecvenţă şi/sau amplitudine a respiraţiei, precum apneea/hipopneea obstructivă de somn (AOS), sindromul de hipoventilaţie secundar obezităţii, apneea centrală de somn, sindromul rezistenţei căilor respiratorii superioare şi respiraţia Cheyne-Stokes.1,2 AOS, forma extremă de tulburare respiratorie legată de somn, se caracterizează prin episoade intermitente de obstrucţie completă sau parţială a căilor respiratorii superioare, care întrerup ventilaţia normală şi etapele fiziologice ale somnului şi se asociază tipic cu sforăit şi oboseală diurnă.3-6 Are consecinţe cardiovasculare, pulmonare, neurologice şi metabolice şi se consideră în prezent o afecţiune sistemică strâns legată de obezitate.3-6 Afectează 2% dintre femei şi 4% dintre bărbaţi (cu vârsta între 30 şi 65 de ani), incidenţa fiind similară cu cea a diabetului zaharat de tip 1.7 Factorii de risc pentru această afecţiune sunt obezitatea, sexul masculin, vârsta crescută şi anomaliile de morfologie craniofacială.8,9 Se asociază pe lângă obezitate şi cu dislipidemia, diabetul zaharat de tip 2, sindromul metabolic şi hipertensiunea arterială.1,2 Astfel, peste 40% dintre pacienţii cu indexul de masă corporală >30 kg/m2 suferă de această maladie, găsindu-se cu prevalenţă la cei cu sindrom metabolic.3
NOŢIUNI DE DIAGNOSTIC A APNEEI OBSTRUCTIVE DE SOMN
Obstrucţiile acute tranzitorii ale faringelui (uneori determinate de modificările morfologice locale) în timpul somnului crează perioade de apnee (scăderea cu >90% a fluxului aerian pentru cel puţin 10 secunde) şi hipopnee (scăderea cu 50% până la 90% a fluxului aerian pentru cel puţin 10 secunde, cu o desaturare a hemoglobinei mai mare de 3% sau trezirile repetate din somn).1 Hipoxemia şi hipercapneea secundară tulburărilor de ventilaţie activează chemoreceptorii şi induc hiperventilaţie şi trezire bruscă (subconştientă, confirmată electroencefalografic).1,2 Indicele apnee-hipopnee, reprezintă numărul mediu de episoade de apnee/hipopnee pe ora de somn.1,2 Un număr de minim 5 episoade de apnee-hipopnee/oră de somn însoţit de treziri frecvente, hipersomnolenţă şi oboseală diurnă, tulburări de concentrare şi memorie pune diagnosticul de AOS.1 Mijloacele de apreciere a severităţii AOS sunt: indicele de apnee-hipopnee, gradul de desaturare nocturnă exprimat printr-o medie sau cea mai joasă saturaţie a oxigenului precum şi durata de somn cu o saturaţie a oxigenului <90%.1-4 Există numeroase teste de somnologie disponibile; se fac măsurători nocturne ale respiraţiei şi tulburărilor de somn precum oximetria, frecvenţa cardiacă, numărul de treziri prin monitorizarea mişcărilor corporale, excitaţiei sistemului nervos simpatic sau a activităţii electrocardiografice.1,4,5 Este necesară efectuarea unui minim de teste pentru a avea un diagnostic de certitudine. Acesta este confirmat de pulsoximetria nocturnă şi polisomnografie (considerată “gold standard“).2 Prezenţa mişcărilor toraco-abdominale arată că apneea este de tip obstructiv şi nu central.2
Există diverse scale de somnolenţă utilizate ca instrument pentru măsurarea somnolenţei diurne excesive în cazul persoanelor suspectate a avea AOS dar care însă nu pot diferenţia cauza. În clinicile de somnologie se folosesc şi pentru evaluarea răspunsului la tratament. Un astfel de instrument este scala Epworth; un scor de minim 9 semnifică somnolenţă diurnă excesivă.1,2 Tabelul 1 prezintă parametrii incluşi în această scală şi anume 8 situaţii în care poate apare somnolenţa diurnă. Prin acordarea de puncte fiecărei situaţii se obţine scorul respectiv (0 reprezintă nu aţipesc/adorm, 1 = şanse foarte mici să aţipesc/să adorm, 2 = şanse moderate să aţipesc/să adorm, 3 = şanse mari să aţipesc/să adorm). Se vor lua în considerare situaţiile de somnolenţă excesivă şi nu doar de oboseală (frecvent întâlnită la femei). În general pacienţii care suferă de AOS au simptome care trenează de luni sau ani de zile, mulţi dintre ei neconştientizând acest fapt. Chestionare mai specifice de screening precum chestionarul Berlin urmăresc identificarea pacienţilor cu risc crescut, în practică având o utilitate scăzută prin numărul mare de cazuri fals negative sau fals pozitive. Dimensiunea gâtului este un parametru util de evaluare a obezităţii tronculare care se corelează semnificativ cu severitatea AOS; astfel cei care au peste 43 cm plus simptome specifice de AOS necesită teste de somnografie.
Tabelul 1. Scala Epworth care include situaţiile în care poate apărea somnolenţa diurnă

CONSECINŢELE CARDIOVASCULARE ALE APNEEI OBSTRUCTIVE DE SOMN
AOS are efecte acute şi cronice asupra aparatului cardiovascular. Hipoxemia sistemică şi hipercapnia, presiunea negativă intratoracică exagerată şi trezirile repetate din somn sunt mecanismele fiziopatologice predominante ce duc la efecte acute asupra aparatului cardiovascular. Pe termen lung apar şi efecte cronice prin dereglarea sistemului nervos autonom, activarea inflamaţiei şi a stresului oxidativ cu efect proaterogen, disfuncţie vasculo-endotelială, status procoagulant şi anomalii metabolice. A fost propus chiar un nou termen, sindromul Z, care să includă pe lângă AOS, hipertensiunea arterială, obezitatea centrală, activitatea simpatică crescută, insulino-rezistenţa sau diabetul zaharat de tip 2, dislipidemia proaterogenă, statusul inflamator şi cel procoagulant crescut.11 Consecinţele cardiovasculare induse de AOS sunt de tip mecanic, autonom, vasculo-endotelial, inflamatorii şi oxidative şi aritmogene cardiace.11 Efectele mecanice cardiace sunt consecinţa modificării presiunii negative intratoracice ce determină creşterea presiunii transmurale a ventriculului stâng şi consecutiv a postsarcinii, un consum miocardic crescut de oxigen, scăderea debitului coronarian, tulburări de contractilitate şi de relaxare miocardică. Creşterea returului venos şi deci a presarcinii ventriculului drept asociată creşterii postsarcinii prin vasoconstricţia arterială pulmonară secundară hipoxiei din AOS duc la mişcarea paradoxală a septului interventricular în detrimentul umplerii ventriculului stâng şi a debitului cardiac. În evoluţie vor apare şi progresa remodelarea cardiacă, hipertrofia ventriculară şi insuficienţă cardiacă. Efectele autonome se datorează stimulării de către hipoxie şi retenţia de bioxid de carbon a chemoreceptorilor centrali şi periferici a sistemului nervos autonom (Figura 1). De asemenea, apneea elimină inhibarea reflexă a sistemului nervos autonom indusă de receptorii de întindere pulmonari. Scăderea debitului cardiac şi consecutiv a tensiunii arteriale stimulează baroreceptorii sino-carotidieni şi implicit sistemul nervos autonom. Acelaşi efect îl au şi trezirile repetate din somn ce duc la diminuarea activităţii vagale nocturne. Hipoxia intermitentă şi reoxigenarea post-apnee determină stres oxidativ, generează specii reactive de oxigen şi promovează inflamaţia. Speciile reactive de oxigen diminuă oxidul nitric şi scade vasodilataţia mediată endotelial favorizând apariţia hipertensiunii arteriale. Totodată duc şi la producerea unor mediatori ai inflamaţiei (TNFα, IL-6, IL-8, proteina C reactivă) şi a unor molecule de adeziune celulară, E selectina şi CD15, consecinţa fiind lezarea endotelială şi promovarea aterogenezei (inclusiv coronariană). Efectele aritmogene sunt induse de hipoxia intermitentă prin imbalanţa simpato-parasimpatică. Prezenţa şi complexitatea tahi şi bradiaritmiilor pot influenţa morbiditatea, mortalitatea şi calitatea vieţii la pacienţii cu AOS.12,13 Sunt în curs de cercetare mecanisme precum stresul oxidativ, inflamaţia şi ţesutul adipos care ar putea explica corelaţia dintre AOS şi afecţiunile cardiovasculare. Un indice apnee-hipopnee de minim 30, ce traduce o formă severă de AOS, se asociază cu un risc crescut de deces inclusiv prin boală coronariană.13 Există deja o serie de markeri subclinici susceptibili de a identifica pacienţii cu risc crescut de evenimente cardiovasculare, precum hipertensiunea arterială mascată (diagnosticată prin monitorizarea ambulatorie a tensiunii arteriale), disfuncţia endotelială (identificată prin măsurarea tonusului arterial periferic), hipertrofia carotidiană (creşterea grosimii intimă-medie), rigiditatea arterială (creşterea velocităţii undei pulsului) şi disfuncţia diastolică (evaluată ecocardiografic). Deşi mecanismul exact al aritmiilor cardiace asociate AOS nu este cunoscut, acesta ar putea fi acelaşi cu cel care o leagă de diferite afecţiuni cardiace. AOS determină colaps faringeal repetat în timpul somnului, desaturarea hemoglobinei, eforturi inspiratorii persistente împotriva unor căi respiratorii închise ce duc la trezire. Aceste modificări induc o serie de răspunsuri autonome, hemodinamice, umorale şi neuroendocrine care produc alterări acute şi cronice ale funcţiilor cardiace.14,15 Cele mai frecvente tipuri de aritmii întâlnite în timpul somnului sunt tahicardia ventriculară (TV) nesusţinută, oprirea cardiacă, blocul atrio-ventricular de gradul II şi extrasistolele ventriculare.14,16-18 Tulburări de ritm precum tahicardia supraventriculară, FA sau flutterul atrial şi în mod particular aritmiile ventriculare de tip TV susţinută sau nu, apar în special la pacienţii cu afecţiuni structurale cardiace.19 În ciuda faptului că hipoxemia, trezirile repetate şi dereglarea sistemului nervos autonom pot cauza focare ectopice, încă nu se ştie exact dacă AOS este un factor etiologic primar al aritmiilor cardiace datorită comorbidităţilor cardiovasculare prezente frecvent la aceşti pacienţi. Nu se cunoaşte semnificaţia prognostică a acestor aritmii şi nici dacă tratamentul acestora sau a AOS are un impact semnificativ asupra morbidităţii şi mortalităţii cardiace.
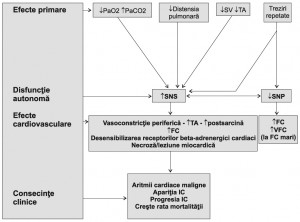
Figura 1. Efectele apneei obstructive de somn asupra componentelor sistemului nervos autonom şi efectele clinice determinate (adaptată după [11]). PaO2 – presiunea arterială a oxigenului, Pa CO2 – presiunea arterială a bioxidului de carbon, SV – stroke volume sau volumul bătaie, TA – tensiunea arterială, SNS – sistem nervos simpatic, SNP – sistem nervos parasimpatic, FC – frecvenţa cardiacă, VFC – variabilitatea frecvenţei cardiace, IC – insuficienţa cardiacă.
ARITMIILE CARDIACE ASOCIATE CU APNEEA OBSTRUCTIVĂ DE SOMN
Prezenţa unei legături între AOS şi aritmiile cardiace a fost afirmată pentru prima dată în urmă cu 30 de ani, când s-a constatat asocierea somnului cu aritmie sinusală marcată (93%), bradicardie sinusală extremă (40%), asistolie (33%), bloc atrioventricular (13%), aritmii ventriculare (66%) şi TV (13%) iar a trezirii doar cu extrasistole ventriculare (40%).20 Numărul mediu al episoadelor de apnee, vârsta, greutatea şi gradul de desaturare a hemoglobinei nu a diferit semnificativ la pacienţii cu aritmii faţă de cei cu tulburări de conducere. 20 Sunt puţine studii care au evaluat riguros legătura AOS cu aritmiile cardiace iar rezultatele acestora sunt contradictorii.17,21 Prevalenţa şi tipul aritmiilor cardiace în studiile de AOS sunt redate în Tabelul 2.12,18,21-28 Acestea sunt mai frecvente la pacienţii cu hipoxemie severă nocturnă în timpul fazei de mişcări rapide oculare.17 Extrasistolele ventriculare, TV nesusţinută şi FA au o prevalenţă crescută la pacienţii cu AOS faţă de cei fără această maladie; procentul lor este mai mare odată cu numărul episoadelor de apnee şi severitatea hipoxemiei.13 După unii autori nu există nicio diferenţă semnificativă statistic între prevalenţa aritmiilor la pacienţii cu sau fără AOS iar prezenţa sau absenţa aritmiilor nu este legată de severitatea AOS.18 Totuşi, se pare că bradiaritmiile apar exclusiv în timpul apneei sau hipopneei şi nu în hiperventilaţie, existând o asociere clară între bradiaritmii şi severitatea apneei.21
Tabelul 2. Prevalenţa şi tipul aritmiilor cardiace în studiile de AOS
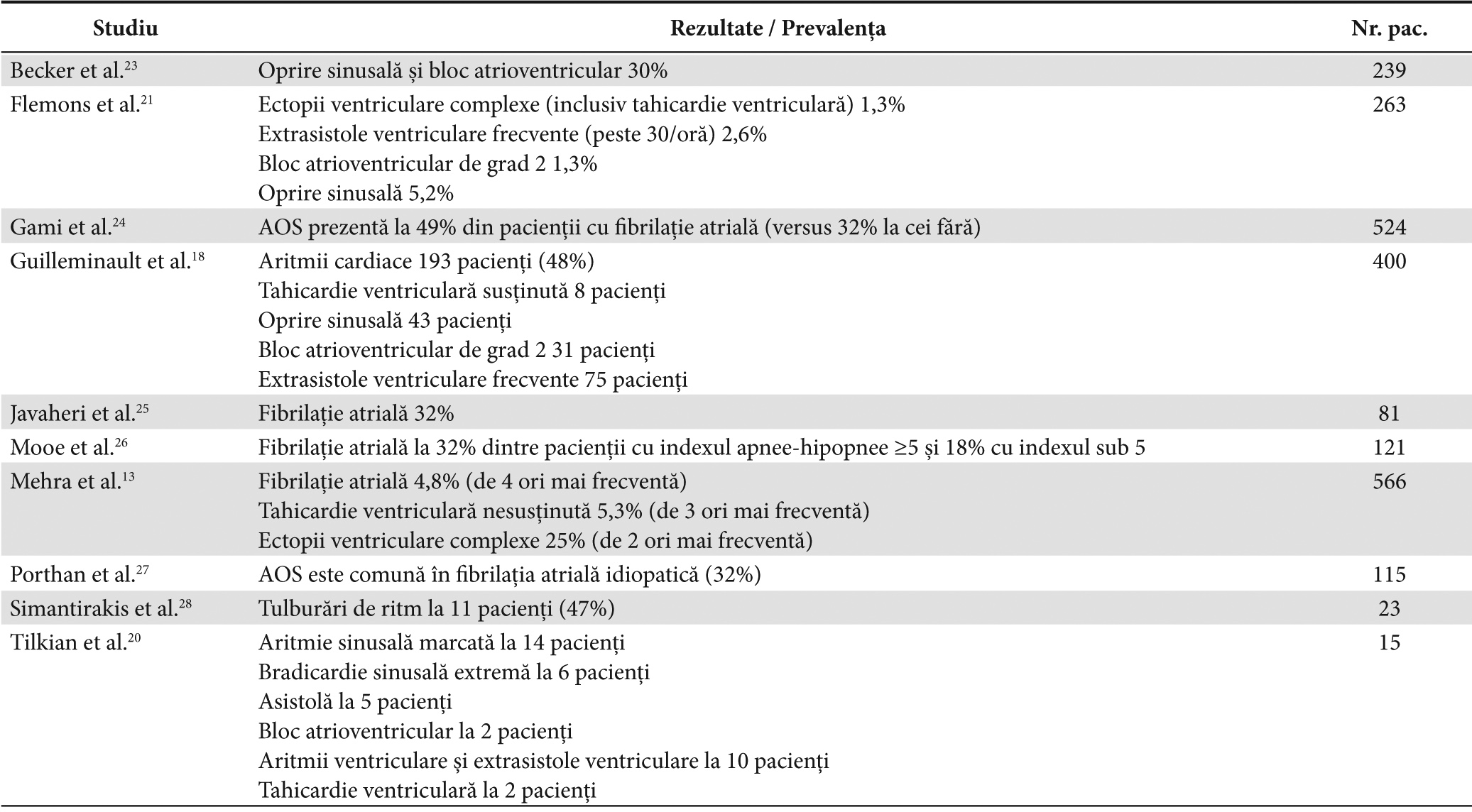
Cea mai frecventă tulburare de ritm este aritmia sinusală sau variaţia ciclică a frecvenţei cardiace (alternarea bradicardiei în perioada de apnee cu tahicardia de după reluarea respiraţiei) fiind propusă ca predictor de diagnostic pozitiv al AOS (având o sensibilitatea crescută dar o specificitate redusă).29 Somnul se asociază frecvent la persoanele sănătoase cu bradiaritmii precum bradicardia sinusală, pauze sinusale sau blocuri atrio-ventriculare de grad I si II tip Mobitz 1. Prezenţa acestora la cei cu factori de risc pentru AOS (bărbaţi de vârstă medie, obezitate, sforăit sau somnolenţă diurnă) indică posibilitatea unei forme de AOS cel puţin moderată. Bradiaritmiile pot apare la 18% dintre pacienţii cu forme severe de AOS, sistemul de conducere cardiac avînd o funcţie normală.18,30 Mai mult, se pare că 50% dintre pacienţii cu implant de pacemaker indicat pentru bradicardie simptomatică, bloc atrio-ventricular sau insuficienţă cardiacă au AOS nediagnosticată încă.31 Implantarea unor device-uri de tip “loop recording” (care permit înregistrarea evenimentelor electrocardiografice pe durata a luni de zile până la maxim 3 ani) la 23 de pacienţi cu AOS la care s-au exclus diabetul zaharat şi alte afecţiuni cardiace şi pulmonare prin test de efort, studiu electrofiziologic, ecocardiografie şi probe funcţionale pulmonare a dus la concluzia, după 2 luni de înregistrare, că 48% dintre aceştia au avut tulburări de ritm semnificative, majoritatea nocturne.28 Monitorizarea holter de 48 de ore se pare că nu permite detecţia bradiaritmiilor.20 Frecvenţa şi severitatea bradiaritmiilor nocturne asociate AOS se corelează cu indexul de masă corporală, indexul apnee-hipopnee şi gradul de desaturare nocturnă iar oxigenoterapia cu presiune continuă pozitivă sau CPAP controlează apariţia acestora.28 Se ştie de peste 20 de ani că AOS se asociază şi cu tahiaritmii, susţinute sau nu, atât atriale cât şi ventriculare. Pacienţii cu istoric de FA au o prevalenţă crescută a AOS.18 Această asociere nu depinde de sex, vârstă, indexul de masă corporală, prezenţa hipertensiunii arteriale sau a insuficienţei cardiace.31 Pentru un cord susceptibil la FA prezenţa AOS determină perpetuarea acestei aritmii, cu risc crescut de apariţie a insuficienţei cardiace şi a accidentului vascular cerebral. Nu există studii prospective de analiză a rolului patogenic a FA în AOS. Acesta are o prevalenţă semnificativ statistic mai mare la pacienţii cu FA decât la cei cu multiple alte afecţiuni cardiace cu risc înalt, existând deci o asociere clară între AOS şi FA.21 Prevalenţa FA este de 4 ori mai mare la pacienţii cu un index apnee-hipopnee peste 30 comparativ cu cei fără tulburări respiratorii legate de somn, pe loturi similare ca vârstă, sex şi comorbidităţi cardiovasculare.13
Un indice apnee-hipopnee de minim 5 la pacienţii supuşi revascularizării miocardice chirurgicale determină o incidenţă a FA postoperatorii mult mai mare decât dacă acesta este sub 5.25 Diagnosticarea preoperatorie la aceşti pacienţi a tulburărilor respiratorii legate de somn este un factor predictor independent al FA postoperatorii.26 La pacienţii cu insuficienţă cardiacă fără comorbidităţi majore dar cu apnee de somn există o prevalenţă semnificativ mai mare a FA şi a aritmiilor ventriculare decât la cei fără apnee de somn.25 De asemenea, analiza datelor înregistrate la pacienţii posesori ai unui defibrilator implantabil, a relevat că 75% dintre episoadele de FA persistentă apar între orele 20.00 şi 8.00, lucru explicabil în parte prin prezenţa AOS.32 Un studiu observational la pacienţii cu forme moderate/severe de AOS a dus la constatarea că 3% dintre aceştia asociau FA paroxistică nocturnă; aceasta s-a remis în maxim 6 luni după instituirea terapiei definitive a apneei.24 Pacienţii cu insuficienţă cardiacă moderată (şi cu fracţie de ejecţie de aprox. 36%) asociază la AOS, FA în 20% din cazuri 25. Se pare că riscul de FA creşte de aproximativ 4 ori la pacienţii cu AOS. FA apare în 5% dintre formele severe de apnee nocturnă şi doar în 1% din cazurile fără această tulburare de somn33. Aceste 2 patologii sunt puternic asociate, prevalenţa ajungând şi până la 32%.24 Recurenţa FA la 1 an după cardioversie electrică este de 83% versus 53% la pacienţii fără această tulburare de somn33. Saturaţia minimă de oxigen şi durata perioadelor cu o saturaţie sub 90% prezic independent recurenţa FA. Recurenţa FA postcardioversie la pacienţii cu AOS este de 82% la un an, în contrast cu 42% şi respectiv 53%, la pacienţii cu AOS trataţi cu CPAP şi la cei din grupul de control (care nu a avut un studiu polisomnografic).34 Tratamentul AOS prin CPAP pare să scadă incidenţa aritmiilor.22 FA după pontajul aorto-coronarian26 ca şi refacerea conducerii la nivelul venelor pulmonare după izolarea acestora35 poate fi prezisă la pacienţii cu AOS. Pentru aceasta din urmă, riscul este de 2.16 şi poate fi legat de remodelarea electrică, fibroza şi dilataţia atrială. Saturaţia în oxigen este un predictor independent al FA la pacienţii cu AOS ceea ce explică utilizarea CPAP în terapia acesteia. Se obţine astfel ameliorarea hipoxiei şi scăderea tonusului simpatic diurn şi nocturn, cu posibilitatea scăderii recurenţelor FA de la 82 la 42%.22,34 Chiar dacă sunt încă unele controverse, există o incidenţă a aritmiilor cardiace complexe de 2 până la 4 ori mai mare la pacienţii cu tulburări severe respiratorii legate de somn decât la cei fără.
Şi extrasistolele ventriculare izolate sau sistematizate şi TV nesusţinută sunt legate de AOS, fiind mult mai comune în prezenţa acestui sindrom chiar după ajustările pentru diabet, hipertensiune arterială, profil lipidic sau insuficienţa cardiacă.13 Prezenţa unei AOS nediagnosticate la pacienţii purtători ai unui defibrilator poate contribui la o rată crescută de terapii (stimulare antitahicardică sau ATP şi/sau soc) corect efectuate la un subgrup dintre aceştia.12 Pacienţii cu AOS netratată şi insuficienţă cardiacă sunt la risc crescut de moarte subită nocturnă; la o 1/3 dintre acestia insuficienţă cardiacă coexistă cu AOS.36 Moartea subită cardiacă de cauză coronariană survine de regulă la trezire între orele 6 şi 10; la pacienţii cu AOS aceasta survine în somn (între miezul noptii şi ora 6), riscul relativ fiind de 2.57.36 Aşadar AOS poate juca un rol important în apariţia morţii subite prin ischemie miocardică, aritmii cardiace maligne sau bradiaritmii severe.
MECANISMELE FIZIOPATOLOGICE ALE ARITMIILOR ASOCIATE CU APNEEA OBSTRUCTIVĂ DE SOMN
Patofiziologia AOS cuprinde câteva mecanisme intermediare ce pot duce la FA, aritmii ventriculare şi moarte subită. Aceste mecanisme intermediare în faza acută joacă rol de „trigger” (trăgaci, declanşator) iar cronic duc la modificarea substratului din punct de vedere electric şi structural. Chiar dacă sunt încă incomplet cunoscute, mecanismele posibil implicate în aritmiile asociate cu AOS sunt: activare simpatică şi parasimpatică, inflamaţie sistemică şi dilatare atrială. AOS determină desaturări repetate ale hemoglobinei, creşterea concomitentă a nivelului bioxidului de carbon în sângele arterial cu activare baroreflexă şi chemoreflexă şi stimularea sistemului nervos autonom simpatic.35 Hipersimpaticotonia generează remodelarea electrică a atriului stâng, facilitarea aritmiilor supraventriculare (în special a FA) prin crearea de blocuri de conducere intraatrială.37 Hipoxemia şi trezirile repetate pot duce la automatism crescut şi focare ectopice. Eforturile ventilatorii împotriva căilor respiratorii obstrucţionate determină variaţii presionale importante la nivelul pereţilor atriilor, modificări structurale acute, activarea canalelor sensibile la întindere şi iniţierea FA.38,39 Markerii de inflamaţie sistemică precum proteina C reactivă cresc în AOS, iar acest fapt se asociază cu incidenţa mai mare a FA.40 Bradiaritmiile sunt probabil legate de apneea prelungită cu hipoxemie care duce la activarea reflexă vagală şi ulterior simpatică la nivelul vaselor periferice din rinichi, muşchi şi splahnice dar nu şi din creier.41 Deşi activarea vagală determină bradicardie, la aproximativ 10% dintre pacienţii cu AOS bradiaritmiile de tip bloc atrioventricular sau asistolă apar în lipsa unei afectări a sistemului de conducere.18 Aceasta are loc cel mai probabil în timpul fazei de somn cu mişcări rapide oculare şi desaturare de cel puţin 4%.40 Respiraţia forţată împotriva obstrucţiei căilor aeriene superioare duce la activare vagală şi mecanisme de reintrare intraatrială prin creşterea dispersiei repolarizării (cu efect aritmogen).33,37 Presiunea intratoracică negativă din tulburările respiratorii legate de somn are un efect de întindere asupra pereţilor liberi atriali şi ventriculari şi poate precipita aritmii prin mecanisme mecano-electrice. În timpul apneei, în fazele precoce sunt oscilaţii semnificative ale tonusului simpatic şi parasimpatic; hipoxia şi hipercapnia stimulează chemoreceptorii periferici şi centrali, cu activare neurală şi umorală simpatică şi vasoconstricţie periferică şi creşterea catecolaminelor. Şi tonusul parasimpatic creşte în egală masură în perioadele de apnee. În apariţia şi menţinerea FA sunt implicate ambele componente ale sistemului nervos autonom. Tonusul simpatic crescut poate sensibiliza canalele ionice activate de catecolamine iar cel vagal poate modifica proprietăţile de conducere ale cardiomiocitului atrial. Fluctuaţiile din activitatea sistemului nervos autonom asociate cu tonus bazal simpatic crescut crează condiţii de iniţiere şi persistenţă a tahiaritmiilor precum şi dificultăţi sau chiar eşec în controlul frecvenţei cardiace. Lărgirea atriului stâng creşte riscul de apariţie a FA. Pacienţii cu AOS sunt de obicei obezi, hipertensivi şi cu un volum sanguin crescut, toate acestea concurând la mărirea atriului stâng. Independent de acestea, AOS determină creşterea volumului atrial. Există şi o disfuncţie diastolică la pacienţii cu această patologie. Gradul acesteia se corelează cu cel al desaturării în AOS.5 Şi markerii inflamatori precum amiloidul A şi proteina C reactivă cresc în AOS, ceea ce contribuie la remodelarea structurală atrială şi la creşterea riscului de FA. Se creează aşadar un cerc vicios care duce nu doar la apariţia ci şi la perpetuarea şi persistenţa FA.
METODE TERAPEUTICE ALE APNEEI OBSTRUCTIVE DE SOMN
Strategia terapeurică a AOS include măsuri generale precum modificarea poziţiei de somn, scădere ponderală, evitarea alcoolului şi sedativelor hipnotice precum şi corecţia chirurgicală a căilor repiratorii superioare atunci cînd este indicată. Se recomandă identificarea precoce a factorilor de risc cardiovascular asociaţi AOS, în special căutarea sistematică a valorilor tensionale crescute la pacienţii cu forme severe ale acestui sindrom mai ales dacă se asociază cu obezitate. În cazul bradiaritmiilor cu sistem cardiac de conducere normal, dacă nu există aritmii semnificative sau blocuri atrioventriculare în timpul perioadelor de apnee, atunci AOS se poate trata eficient cu CPAP şi nu este necesar implantul de pacemaker.9,41 Tratamentul AOS duce la controlul aritmiilor asociate cu aceasta. Pacienţii cu FA şi AOS supuşi cardioversiei au o rată de recurenţă de 2 ori mai mare în primele 12 luni faţă de cei trataţi cu CPAP.34 Terapia prin CPAP la pacientii cu forme moderate şi severe de AOS, se pare că este eficientă şi asupra tahicardiei sau fibrilaţiei ventriculare, ectopiilor ventriculare sau tahicardiilor supraventriculare debutate recent.22 Extrasistolele ventriculare la pacienţii cu insuficienţă cardiacă care prezintă şi AOS sunt reduse prin terapia cu CPAP cu 58% în perioadele de somn.42 Într-un studiu cu o perioadă de urmărire de 10 ani, s-a constatat un risc mult mai mare de evenimente cardiovasculare fatale sau nu, la pacienţii cu AOS severă necomplianţi la terapia cu CPAP faţă de sforăitori, cei complianţi la CPAP şi bărbaţii sănătoşi.43 Este primul studiu care a atestat pe termen lung efectele nefavorabile ale AOS asupra aparatului cardiovascular şi creşterea morbidităţii şi mortalităţii. Tratamentul cu CPAP este recomandat la pacienţii cu AOS cu simptome moderate sau severe; pentru cei cu simptomatologie minoră se indică doar dacă alte metode de tratament mai simple nu au funcţionat sau nu sunt adecvate (scăderea în greutate, îmbunătăţirea igienei somnului şi dispozitive de avansare a mandibulei, deşi până în prezent există puţine dovezi care sprijină aceste abordări terapeutice). Intervenţiile chirurgicale în sfera ORL implică amigdalectomia în cazul unor amigdale foarte mari. Uvulo-palato-faringoplastia nu este susţinută de dovezi de ameliorare a sforăitului sau a AOS şi de aceea este mai puţin utilizată. Chirurgia bariatrică se pare că poate fi o metodă importantă de tratament, atunci când este accesibilă.
Cardiostimularea părea a fi o nouă metodă terapeutică la unii pacienţi cu AOS, pornind de la constatarea că stimularea rapidă atrială (“overdrive pacing”) atenuează severitatea apneei centrale de somn dar şi a AOS44. Acest lucru nu s-a confirmat însă ulterior. În prezent, sunt în studiu perspectivele acestei noi metode, ale cărei mecanisme încă nu se cunosc. Totuşi compararea terapiei prin CPAP cu cea prin stimulare atrială a evidenţiat efectul benefic al CPAP asupra severităţii AOS şi absenţa vreunei eficienţe a stimulării atriale la 24 de ore şi la o lună, într-un studiu mic, prospectiv44. Astfel, stimularea atrială permanentă la pacienţii cu AOS, forme moderate până la severe, se pare că nu este justificată, deoarece nu îmbunătăţeşte manifestările respiratorii din AOS. Excepţie fac unele situaţii particulare precum pacienţii cu insuficienţă cardiacă şi AOS, în care stimularea atrială rapidă ar putea avea un efect mediu asupra evenimentelor respiratorii45. Oricum această metodă nu reprezintă încă o indicaţie terapeutică în AOS.
CONCLUZII
Apneea obstructivă de somn este considerată o afecţiune sistemică strâns legată de obezitate sau chiar un factor de risc independent care duce la creşterea morbi-mortalităţii cardiovasculare. Se asociază atât cu bradiaritmii cât şi tahiaritmii. Până în prezent nu există o scală de cuantificare a riscului de aritmii la pacienţii cu apnee obstructivă de somn şi nici nu se cunosc implicaţiile prognostice ale acestora. De aceea problema aritmiilor cardiace asociate apneei obstructive de somn rămâne o cale deschisă cercetării medicale.
Conflict de interese: niciunul.
Bibliografie
1. American Academy of Sleep Medicine Task Force. Sleep-related breathing disorders in adults: Recommendations for syndrome definition and measurement techniques in clinical research The Report of an American Academy of Sleep Medicine Task Force. Sleep 1999;22:667-89
2. Malhotra A, White DP. Obstructive sleep apnea. Lancet 2002;360:237-45.
3. Quan SF, Gersh BJ. Cardiovascular consequences of sleep-disordered breathing: Past, present and future report of a workshop from the national center on sleep disorders research and the national heart, lung, and blood institute. Circulation 2004;109:951-7.
4. Lattimore JD, Celermajer DS, Wilcox I. Obstructive sleep apnea and cardiovascular disease. J Am Coll Cardiol 2003;41:1429-37.
5. Shamsuzzaman AS, Gersh BJ, Somers VK. Obstructive sleep apnea: Implications for cardiac and vascular disease. JAMA 2003;290:1906-14.
6. Bradley TD, Floras JS. Sleep apnea and heart failure: Part I: Obstructive sleep apnea. Circulation 2003;107:1671-8.
7. Young T, Palta M, Dempsey J et al. The occurrence of sleep-disordered breathing among middle-aged adults. N Engl J Med 1993;328:1230-5.
8. Partinen M. Epidemiology of obstructive sleep apnea syndrome. Curr Opin Pulm Med 1995;1:482-7.
9. Parati G, Lombardi C, Narkiewicz K. Sleep apnea: Epidemiology, pathophysiology, and relation to cardiovascular risk. Am J Physiol Regul Integr Comp Physiol 2007;293:R1671-83.
10. Nock N, Li L, Larkin E et al. Empirical evidence for Syndrome Z: a hierarchical 5-factor model of the metabolic syndrome incorporating sleep disturbance measures. Sleep 2009: 32:615-622.
11. Kasai T, Bradley D. Obstructive Sleep Apneea and Heart Failure. Pathophysiologic and Therapeutic Implications. J Am Coll Cardiol 2011;
57:119-27.
12. Arias MA, Sánchez AM. Obstructive sleep apnea and its relationship to cardiac arrhythmias. J Cardiovasc Electrophysiol 2007;18:1006-14.
13. Mehra R, Benjamin EJ, Shahar E et al. Association of nocturnal arrhythmias with sleep-disordered breathing: The sleep heart health study. Am J Respir Crit Care Med 2006;173:910-6.
14. Koehler U, Schafer H. Is obstructive sleep apnea (OSA) a risk factor for myocardial infarction and cardiac arrhythmias in patients with coronary heart disease (CHD)? Sleep 1996;19:283-6.
15. Somers VK, White DP, Amin R et al. Sleep Apnea and Cardiovascular Disease: An American Heart Association/American College of Cardiology Foundation Scientific Statement From the American Heart Association Council for High Blood Pressure Research Professional Education Committee, Council on Clinical Cardiology, Stroke Council, and Council on Cardiovascular Nursing In Collaboration With the National Heart, Lung, and Blood Institute National Center on Sleep Disorders Research (National Institutes of Health). Circulation 2008;118:1080-111.
16. Liston R, Deegan PC, McCreery C, McNicholas WT. Role of respiratory sleep disorders in the pathogenesis of nocturnal angina and arrhythmias. Postgrad Med J 1994;70:275-80.
17. Shepard JW, Garrison MW, Grither DA, Dolan GF. Relationship of ventricular ectopy to oxyhemoglobin desaturation in patients with obstructive sleep apnea. Chest 1985;88:335-40.
18. Guilleminault C, Connolly SJ, Winkle RA. Cardiac arrhythmia and conduction disturbances during sleep in 400 patients with sleep apnea syndrome. Am J Cardiol 1983;52:490-4.
19. Randazo DN, Winters SL, Schweitzer P. Obstructive sleep apnea induced supraventricular tachycardia. J Electrocardiol 1996;29:65-7.
20. Tilkian AG, Guilleminault C, Schroeder JS et al. Sleep-induced apnea syndrome: Prevalence of cardiac arrhythmias and their reversal after tracheostomy. Am J Med 1977;63:348-58.
21. Flemons WW, Remmers JE, Gillis AM. Sleep apnea and cardiac arrhythmias: Is there a relationship? Am Rev Respir Dis 1993;148:618-21.
22. Harbison J, O’Reilly P, Mc Nicholas WT. Cardiac rhythm disturbances in the obstructive sleep apnea syndrome: Effects of nasal continuous positive airway pressure therapy. Chest 2000; 118:591-5.
23. Becker H, Brandenburg U, Peter JH, von Wichert P. Reversal of sinus arrest and atrioventricular conduction block in patients with sleep apnea during nasal continuous positive airway pressure. Am J Respir Crit Care Med 1995;151:215-8.
24. Gami AS, Pressman G, Caples SM, et al. Association of atrial fibrillation and obstructive sleep apnea. Circulation 2004;110:364-7.
25. Javaheri S, Parker TJ, Liming JD et al. Sleep apnea in 81 ambulatory male patients with stable heart failure: Types and their prevalences, consequences, and presentations. Circulation 1998;97:2154-9.
26. Mooe T, Gullsby S, Rabben T, Eriksson P. Sleep-disordered breathing: A novel predictor of atrial fibrillation after coronary artery bypass surgery. Coron Artery Dis 1996;7:475-8.
27. Porthan KM, Melin JH, Kupila JT, Venho KK, Partinen MM. Prevalence of sleep apnea syndrome in lone atrial fibrillation: A case-control study. Chest 2004;125:879-85.
28. Simantirakis EN, Schiza SI, Marketou E et al. Severe bradyarrhythmias in patients with sleep apnoea: The effect of continuous positive airway pressure treatment A long-term evaluation using an insertable loop recorder. Eur Heart J 2004;25:1070-6.
29. Stein PK, Duntlez SP, Domitrovich PP et al. A simple method to identifz sleep apnea using Holter recordings. J Cardiovasc Electrophysiol 2003; 14:467-473.
30. Grimm W, Hoffmann J, Menz V et al. Electrophysiologic evaluation of sinus node function and atrioventricular conduction in patients with prolonged ventricular asystole during obstructive sleep apnea. Am J Cardiol 1996; 77: 1310-14.
31. Garrigue S, Pepin JL, Defaze P et al. High prevalence of sleep apnea syndrome in patients with long-term pacing. The European multicenter polysomnographic study. Circulation 2007; In press.
32. Mitchell AR, Spurrell PA, Sulke N. Circadian variation of arrhythmia onset patterns in patients with persistent atrial fibrillation. Am Heart J 2003;146:902-7.
33. Conti JB, Cardiac arrhythmias. J Am Coll Cardiol 2005;45:30B-2B.
34. Kanagala R, Murali NS, Friedman PA et al. Obstructive sleep apnea and the recurrence of atrial fibrillation. Circulation 2003;107:2589-2594.
35. Sauer WH, McKernan ML, Lin D et al. Clinical predictors and outcomes associated with acute return of pulmonary vein conduction during pulmonary vein isolation for treatment of atrial fibrillation. Heart Rhythm 2006;3:1024-1028.
36. Gami AS, Howard DE, Olson EJ et al. Day-night pattern of sudden death in obstructive sleep apnea. N Engl J Med 2005; 352:1206-1214.
37. Allesie M, Ausma J, Schotten U. Electrical, contractile and structural remodeling during atrial fibrillation. Cardiovasc Res 2002;54:230-46.
38. Dimsdale JE, Loredo JS, Profant J. Effect of continuous positive airway pressure on blood pressure: A placebo trial. Hypertension 2000;35:
144-7.
39. Franz MR, Bode F. Mechano-electrical feedback underlying arrhythmias: The atrial fibrillation case. Prog Biophys Mol Biol 2003;82:163-74.
40. Koehler U, Fus E, Grimm W et al. Heart block in patients with obstructive sleep apnoea: Pathogenetic factors and effects of treatment. Eur Respir J 1998;11:434-9.
41. Stegman SS, Burroughs JM, Henthorn RW. Asymptomatic bradyarrhythmias as a marker for sleep apnea: Appropriate recognition and treatment may reduce the need for pacemaker therapy. Pacing Clin Electrophysiol 1996;19:899-904.
42. Ryan CM, Usui K, Floras JS, Bradley TD. Effect of continuous positive airway pressure on ventricular ectopy in heart failure patients with obstructive sleep apnoea. Thorax 2005;60:781-5.
43. Marin JM, Carrizo SJ, Vicente E, Agusti AG. Long-term cardiovascular outcomes in men with obstructive sleep apnoea-hypopnoea with or without treatment with continuous positive airway pressure: An observational study. Lancet 2005;365:1046-53.
44. Garrigue S, Bordier P, Jaïs P et al. Benefit of atrial pacing in sleep apnea syndrome. N Engl J Med 2002;346:404-12.
45. Sharafkhaneh A, Sharafkhaneh H, Bredikus A et al. Effect of atrial overdrive pacing on obstructive sleep apnea in patients with systolic heart failure. Sleep Med 2007;8:31-6.
 This work is licensed under a
This work is licensed under a