Mihaela Rugină1, Mihaela Sălăgean1, L. Predescu1, E. Apetrei1,2
Articol primit la data de 03 ianuarie 2012. Articol acceptat la data de 07 februarie 2012
1 Institutul de Urgenţă pentru Boli Cardiovasculare „Prof. Dr. C.C. Iliescu”
2 Facultatea de Medicină şi Farmacie „Carol Davila”, București
Dr. Mihaela Rugină, Institutul de Urgenţă pentru Boli Cardiovasculare “Prof. Dr. C. C. Iliescu”, Şos. Fundeni 258, Sector 2, 022328, Bucureşti
E-mail: rugina.mihaela@gmail.com
Rezumat: Tratamentul anticoagulant în scopul prevenirii evenimentelor trombo-embolice şi a accidentului vascular cerebral în fibrilaţie atrială (FA) este în prezent realizat de antagonişti de vitamină K. Numeroasele interacţiuni medicamentoase şi interacţiunea cu diverse produse alimentare, variabilitatea interindividuală a dozei, precum şi fereastra terapeutică îngustă fac ca utilizarea pe termen lung a acestor medicamente să fie dificilă1,2. Prin urmare, noi anticoagulante orale care blochează selectiv factori cheie în cascada coagulării sunt în curs de dezvoltare, fie ţinta directă a trombinei (dabigatran) sau al factorului Xa (rivaroxaban, apixaban, edoxaban) şi tind să aibă mai multe proprietăţi farmacocinetice previzibile, eficacitate şi siguranţă superioară, cu avantajul de a putea fi administrate şi pe cale orală pentru prevenirea accidentului vascular cerebral în FA precum şi în tratamentul şi profilaxia secundară a trombo-embolismului venos4. Această prezentare rezumă rezultatele studiilor clinice recent publicate privind noii agenţi anticoagulanţi orali, defineşte limitele stabilite de anticoagulante orale existente, avantajele potenţiale ale noilor agenţi, şi discută despre oportunităţi, cât şi incertitudini în aplicaţiile clinice ale acestora.
Cuvinte cheie: anticoagulante orale, dabigatran, rivaroxaban, apixaban, fibrilaţie atrială, trombo-embolism
Abstract: Anticoagulant therapy to prevent thromboembolic events and stroke in atrial fibrillation is currently realized by vitamin K antagonists. Numerous drug and food interactions, inter individual variability in dose, and narrow therapeutic window make long-term use of these drugs to be difficult1,2. Therefore, novel oral anticoagulants that selectively blocks the coagulation cascade are developing, and are direct target of thrombin (dabigatran) or Factor Xa (rivaroxaban, apixaban, edoxaban) and tend to have more predictable pharmacokinetic properties, upper efficacy and safety, with the advantage that it can be administered orally in stroke prevention in AF as well as in treatment and secondary prophylaxis of venous thromboembolism4. Dabigatran etexilate is the first representative of new generation of oral anticoagulants – direct thrombin inhibitors. This review summarizes the results of recently published clinical trials on new oral anticoagulant agents, defines the limits of existing oral anticoagulants, the potential advantages of new agents, and discuss opportunities and uncertainties in their clinical applications.
Keywords: oral anticoagulation, dabigatran, rivaroxaban, apixaban, atrial fibrillation, thromboembolism
INTRODUCERE
Timp de peste 50 ani, tratamentul anticoagulant pe termen lung şi prevenirea evenimentelor trombo-embolice, precum şi prevenirea accidentului vascular cerebral în fibrilaţia atrială (FA) a fost realizat de antagoniştii de vitamină K (AVK). AVK îşi exercită efectul lor anticoagulant prin inhibarea ciclului de conversie al vitaminei K. Vitamina K este un cofactor pentru carboxilarea glutamatului de la capatul N-terminal al proteinelor dependente de vitamina K. Factorii de coagulante II, VII, IX, X necesită carboxilare pentru a deveni activi biologici. Pe lângă acest efect, AVK inhibă şi carboxilarea proteinelor C şi S cu efect anticoagulant, rezultând în final un status protrombotic. Deşi reprezintă un tratament eficient în condiţii optime, riscul iminent al unui eveniment trombo-embolic recurent în raport cu riscul de sângerare din cauza unei ferestre terapeutice înguste, numeroasele interacţiuni cu alimentaţia dar şi cu unele medicamente, precum şi necesitatea de monitorizare periodică a INR-ului, complică şi îngreunează utilizarea pe termen lung a acestei terapii esenţiale în prevenirea şi tratatarea bolii trombo-embolice.
Noile anticoagulante orale ce blochează selectiv factorii cheie în cascada coagulării sunt în curs de evaluare (Figura 1). Eficacitatea şi siguranţa inhibitorilor direcţi de trombină – factorul IIa (dabigatran etexilat), precum şi a inhibitorilor selectivi ai factorului Xa (rivaroxaban şi apixaban), au fost demonstrate în studii de fază III pentru prevenirea accidentului vascular cerebral în FA precum şi în tratamentul şi profilaxia secundară a trombo-embolismului venos. Aceşti agenţi anticoagulanți noi tind să aibă mai multe proprietăţi farmacocinetice previzibile, eficacitate superioară şi siguranţă, cu avantajul de a putea fi administraţi şi pe cale orală3,36,37. Astfel, după aproximativ 50 de ani de la descoperirea warfarinei, epoca antagoniştilor vitaminei K pare să ajungă la un sfârşit în curând.
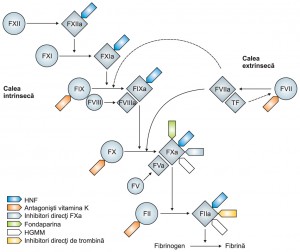
Figura 1. Cascada coagulării şi diversele mecanisme de acţiune ale anticoagulantelor orale noi
Această prezentare rezumă rezultatele studiilor clinice recent publicate, defineşte limitele stabilite de anticoagulante orale şi parenterale, descrie avantajele potenţiale ale noilor agenţi, şi discută despre oportunităţi, cât şi incertitudini în aplicaţiile clinice ale acestor agenţi noi, prevede perspectiva cu privire la oportunităţile şi provocările cu anticoagulante orale şi parenterale noi.
DEZAVANTAJELE ANTAGONIŞTILOR DE VITAMINA K
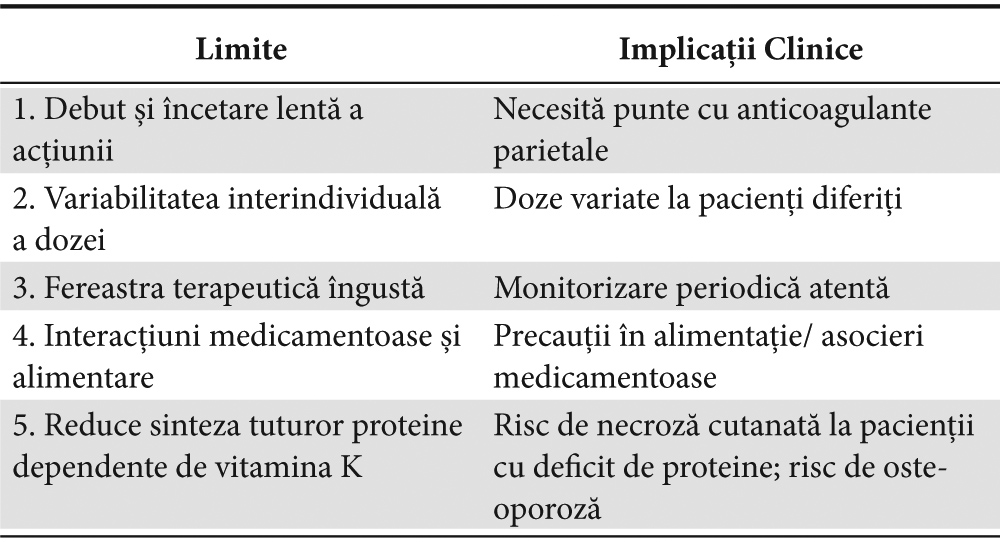
AVK prezintă o serie de inconveniente, care determină sub-utilizarea lor. Astfel, dată fiind fereastra terapeutică îngustă, mulţi pacienţi sunt trataţi suboptimal, doar aproximativ jumătate plasându-se un timp adecvat în ţinta terapeutică. Principalele inconveniente ale anticoagulantelor orale din categoria AVK (rezumate în Tabelul 1)4 constau în:
– debutul întârziat al efectului şi încetarea lentă a efectului anticoagulant la oprirea tratamentului, care prelungesc de multe ori spitalizarea, şi, astfel, cresc costurile de asistenţă medicală. În faţa unei intervenţii chirurgicale de urgenţă, efectul lent reversibil al cumarinicelor impune utilizarea vitaminei K, suplimentată cu transfuzii de plasmă proaspătă sau complex concentrat de protrombină, în funcţie de urgenţa situaţiei. Chirurgia electivă impune de asemenea întreruperea terapiei cu AVK şi utilizarea anticoagulantelor parenterale cu heparine fracţionate/nefracţionate ca ”punte” anterior intervenţiei.
– mare variabilitate interindividuală în relaţia doză-răspuns datorită polimorfismului genic al principalei izoenzime a citocromului P 450 (CYP 2C9) care metabolizează cumarinicile.
– multiplele interacţiuni medicamentoase
Tabelul 1. Limitele AVK (4,9)
Toate acestea implică doze variate de AVK la diferiţi pacienţi.
– AVK prezintă fereastră terapeutică îngustă necesitând monitorizare regulată a Raportului Normalizat Internaţional (INR) şi în ciuda ajustării atente a dozei, INR-ul este frecvent în afara intervalului de ţintă terapeutică, ceea ce măreşte riscul de tromboembolism în cazul subdozării şi al riscului de hemoragie în cazul supradozării cumarinice4,5.
Doar 50% până la 70% din pacienţii cu fibrilaţie atrială cu risc de accident vascular cerebral, eligibili pentru tratament anticoagulant sunt trataţi cu un antagonist al vitaminei K, iar menţinerea valorilor INR între limitele terapeutice nu s-a dovedit a fi posibilă pentru mai mult de 65-70% în cele mai specializate centre clinice de management al anticoagulării6-8. O astfel de monitorizare este incomodă atât pentru pacienţi cât şi pentru medici şi costisitoare pentru sistemul de sănătate.
Pentru a reduce variabilitatea inter-individuală a dozei, au fost dezvoltate algoritme pe baza datelor clinice şi genetice, validate pentru estimarea dozei adecvate de warfarină, clinici specializate în monitorizarea şi dozarea tratamentului anticoagulant dar dovezi ale eficienţei costurilor de testare farmacogenetică pentru a optimiza dozarea warfarinei în practica clinică de rutină lipsesc.
Ca rezultat al acestor limitări, mai mulţi agenţi anticoagulanti au fost studiaţi pentru a înlocui AVK. Spre deosebire de acestea din urmă, care blochează sinteza a formelor inactive a factori de coagulare dependenţi de vitamina K- Factorii II, VII, IX, X, aceşti noi agenţi anticoagulanţi inhibă selectiv forma activă a unui singur factor din cascada de coagulare. Din numeroasele clase de medicamente noi, inhibitorii factorul Xa (FXa) şi inhibitorii direcţi de trombină au fost studiaţi cel mai mult în diverse indicaţii terapeutice.
Figura 2. Formula chimică a dabigatranului
Deşi nevoia de anticoagulante noi administrate pe cale parenterală a fost mai puţin presantă, mai multe anticoagulante noi parenterale sunt în stadii avansate de dezvoltare. Propusă pentru a acţiona mai specific pentru FXa decât heparinele cu greutate moleculară mică, AVE5026 este o heparină cu greutate moleculară ultra-mică, idrabiotaparinux, un pentazaharid sintetic şi otamixaban acţionează selectiv asupra FXa, RB006- un anticoagulant ARN aptamer care vizează în mod specific factorul IXa. Toate aceste noi anticoagulante pe cale parenterală au un debut rapid de acţiune şi produc un efect anticoagulant previzibil, care, în cazul de idrabiotaparinux şi RB006, poate fi rapid neutralizat prin administrarea intravenoasă de avidin, o proteină de legare biotină, sau RB0074.
Primul inhibitor direct de trombină oral studiat a fost ximelagatran, un pro-drog care este metabolizat în metabolitul activ melagatran, însă datorită riscului crescut de hepatotoxicitate nu a fost acceptat de către Food and Drug Administration (FDA).
Astfel, noi anticoagulante, cu ţintă directă a trombinei (dabigatran) sau al FXa (rivaroxaban, apixaban, edoxaban) tind să aibă mai multe proprietăţi farmacocinetice previzibile, eficacitate superioară şi siguranţă mai mare4,9. Noile anticoagulante orale, au avantajul unui debut rapid al acţiunii nefiind necesară suplinirea cu heparine parenterale, au un efect coagulant predictibil fără a fi necesară monitorizarea periodică a coagularii, un risc scăzut de efecte adverse ca urmare a acţiunii la nivelul ezimelor specifice din cascada coagulării şi nu în ultimul rând un risc mult diminuat de interacţiuni medicamentoase sau alimentare.
Aceste proprietăţi ale noilor anticoagulante orale se apropie de proprietăţile unui anticoagulant oral ”ideal” care ar trebui să aibă următoarele calităţi: 1) eficacitate dovedită prin studii, 2) risc scăzut de sângerare, (3) doza fixă, 4) biodisponibilitatea orală bună, 5) clearance extrarenal – pentru siguranţa administrării la bolnavii renali 6) lipsa monitorizării periodice, 7) debut rapid al acţiunii, 8) bună şi rapidă reversibilitate, 9) antidot disponibil, 10) lipsa interacţiunilor medicamentoase sau alimentare.
A. DABIGATRAN ETEXILAT
Aprobarea dabigatran etexilat în Europa constituie un progres semnificativ. Dabigatran etexilat este primul reprezentant al noii generaţii de anticoagulante orale – inhibitorii direcţi de trombină. Efectul antitrombotic puternic este obţinut prin blocarea specifică a activității trombinei (atât trombina liberă cât şi pe cea fixată de trombi).
Acţiunea anticoagulantă a dabigatranului rezidă din faptul că acesta prelungeşte timpul parţial de tromboplastină activată (aPTT), care vizează calea intrinsecă de coagulare şi timpul de trombină, care evaluează în mod direct activitatea de trombină într-un eşantion de plasmă. Cu toate acestea, la concentraţii plasmatice relevante clinic, dabigatranul are un efect relativ mic, nesemnificativ asupra timpului de protrombină şi a INR, care vizează calea de coagulare extrinsecă.
Dabigatran etexilat este un precursor cu moleculă mică care nu prezintă nicio activitate farmacologică.
După administrarea orală, dabigatran etexilat este absorbit rapid şi transformat în dabigatran care este forma plasmatică activă prin hidroliză catalizată de esterază în plasmă şi în ficat. Dabigatran este un inhibitor puternic, competitiv, direct reversibil al trombinei şi este principiul activ principal în plasmă. Scindarea precursorului dabigatran etexilat, prin hidroliză catalizată de esterază – enzima omniprezentă în intestin, plasmă şi ficat, în principiul activ dabigatran, este reacţia metabolică predominantă10,11.
Biodisponibilitatea absolută a dabigatranului după administrare orală este de 6,5%, astfel că doze relativ mari trebuie administrate pentru a se asigura concentraţii plasmatice adecvate.
Există o corelaţie clară între concentraţia plasmatică a dabigatranului şi gradul efectului anticoagulant, bazată pe studii de fază II11,12.
După administrare orală de dabigatran la voluntari sănătoşi, profilul farmacocinetic al dabigatranului în plasmă este caracterizat de o creştere rapidă a concentraţiilor plasmatice cu concentraţie maximă (Cmax) atinsă în decurs de 0,5 şi 2,0 ore de la administrare (în medie, 1,5 ore).
S-a observat o legare în proporţie mică (34-35%), independentă de concentraţie, a dabigatran de proteinele plasmatice umane11-13.
Metabolizarea dabigatran etexilat la dabigatran este finalizată în ficat şi 20% este conjugată cu acidul glucuronic şi excretată prin sistemul biliar. Dabigatran etexilat nu este metabolizat de enzimele citocromului P450 sau alte oxidoreductaze, dar este un substrat al glicoproteinei P. Se excretă în proporţie de 80% pe cale renală, astfel că în prezenţa insuficienţei renale monitorizarea funcţiei renale şi riscul de sângerare trebuiesc evaluate mai atent.
Timpul mediu de înjumătăţire plasmatică al dabigatranului după administrare orală este de cca. 8 ore după o singură doză şi variază în jur de 12-14 ore după doze multiple (în medie 13 ore); timpul de înjumătăţire este crescut la peste 24 ore la pacienţii cu clearance de creatinina sub 30 mL/min11-13.
Dabigatran etexilat este disponibil sub formă de capsule (110 şi 150 mg) şi este administrat în două doze pe zi.
Dabigatran etexilat constituie substratul transportorului de eflux glicoproteinei P, prin urmare administrarea concomitentă de inhibitori ai glicoproteinei P, cum ar fi chinidina, ketoconazol, amiodarona, verapamil pot creşte nivelul plasmatic prin reducerea reabsorbţie sale. Inductorii puternici ai glicoproteinei P, cum ar fi rifampicina, pot reduce concentraţiile plasmatice ale dabigatranului prin creşterea reabsorbţie sale în intestin (Tabelul 2)11-13.
Tabelul 2. Interacţiuni medicamentoase dabigatran (11-13)
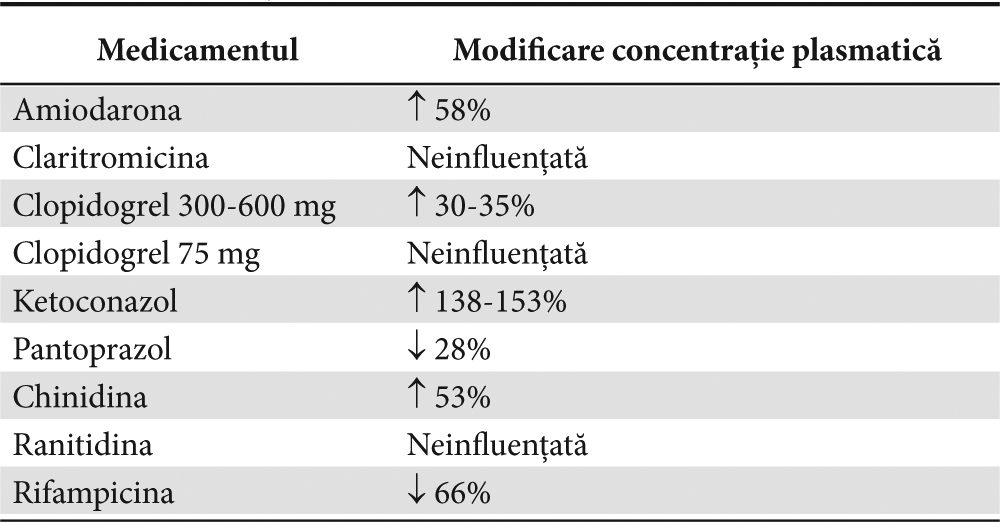
Administrarea concomitentă de dabigatran etexilat cu alte anticoagulante, antiagregante plachetare ar trebui să fie abordată cu precauţie din cauza unui risc crescut de sângerare. Administrarea concomitentă a unui inhibitor de pompă de protoni, cum ar fi pantoprazolul reduce uşor concentraţia maximă de dabigatran, dar nu afectează în mod semnificativ eficacitatea şi siguranţa. Nu este cunoscută interacţiunea dabigatranului etexilat cu alte medicamente, şi absorbţia acestuia nu este afectată de alimente. Administrarea de dabigatran cu atorvastatină, diclofenac, sau digoxină a fost sigură şi bine tolerată, fără a afecta testele de coagulare (Tabelul 2).
Administrarea de dabigatran a fost asociată de sângerări gastrointestinale care au fost semnificative statistic pentru doza de 150 mg dabigatran administrat de două ori pe zi. Acest risc crescut a fost observat la vârstnici (≥75 ani), la pacienţi cu insuficienţă renală (30-50 ml/min ClCr), greutate corporală <50 kg sau medicaţie concomitentă cu inhibitori ai glicoproteinei P (de ex. amiodaronă, chinidină sau verapamil) ce duc la concentraţii plasmatice crescute ale dabigatran. Utilizarea acidului acetilsalicilc (AAS), clopidogrelului sau a medicamentelor antiinflamatoare nesteroidiene (AINS) ca şi prezenţa unor afecţiuni ca esofagita, gastrita sau refluxul gastroesofagian ce necesită administrarea unor inhibitori ai pompei de protoni (IPP) sau a tratamentului cu blocanţi ai receptorilor histaminici (H2) creşte riscul de sângerare gastrointestinale. La aceşti pacienţi trebuie avută în vedere administrarea unei doze de 110 mg dabigatran de două ori/zi14,15.
INDICAŢIILE CLINICE ALE DABIGATRANULUI. STUDII CLINICE
În prezent, dabigatranul este aprobat în următoarele situaţii clinice:
(1) prevenţia primară a evenimentelor tromboembolice venoase la pacienţii adulţi care au suferit o intervenţie chirurgicală electivă de înlocuire completă de şold (RE-NOVATE, RE-NOVATE II) (Dabigatran etexilate versus enoxaparin for prevention of venous thromboembolism after total hip replacement)16 sau o intervenţie chirurgicală de înlocuire completă a genunchiului (RE-MODEL) (Oral dabigatran etexilate vs. subcutaneous enoxaparin for the prevention of venous thromboembolism after total knee replacement: the RE-MODEL randomized trial), RE-MOBILIZE (Oral thrombin inhibitor dabigatran etexilate vs North American enoxaparin regimen for prevention of venous thromboembolism after knee arthroplasty surgery)18.
(2) tratamentul trombembolismului venos acut (RE-COVER, RE-COVER II (Dabigatran etexilate versus warfarin in the treatment of venous thromboembolism))18
(3) prevenţia accidentelor vasculare cerebrale şi a emboliei sistemice la pacienţi adulţi cu fibrilaţie atrială nonvalvulară ce prezintă unul sau mai mulţi dintre următorii factori de risc, studiul RE-LY (Randomized Evaluation of Long Term Anticoagulant Therapy)19-21:
- Antecedente de accident vascular cerebral, atac ischemic tranzitoriu sau embolie sistemică
- Fracţie de ejecţie a ventriculului stâng <40%
- Insuficienţă cardiacă simptomatică, ≥ Clasa II New York Heart Association (NYHA)
- Vârsta ≥ 75 ani
- Vârsta ≥ 65 ani şi una sau mai multe dintre următoarele afecţiuni: diabet zaharat, boală arterială coronariană sau hipertensiune arterială.
(4) prevenţia secundară a trombembolismului venos (RE-MEDY) (Active Controlled Study to Evaluate the Efficacy and Safety of Oral Dabigatran Etexilate Compared to Warfarin for the Secondary Prevention of Venous Thromboembolism), (RE-SONATE) (Dabigatran etexilate in the long-term prevention of recurrent symptomatic venous thromboembolism in patients who have completed 6-18 months of treatment and are considering discontinuation of anticoagulation)
(5) prevenţia secundară a evenimentelor cardiovasculare la pacienţii cu sindrom coronarian acut (RE-DEEM) (RandomizEd Dabigatran Etexilate Dose Finding Study in Patients With Acute Coronary Syndromes Post Index Event With Additional Risk Factors for Cardiovascular Complications Also Receiving Aspirin and Clopidogrel)22
1. Prevenţia primară a evenimentelor tromboembolice venoase la pacienţii adulţi care au suferit o intervenţie chirurgicală electivă de înlocuire completă de şold (RENOVATE, RE-NOVATE II)17 sau o intervenţie chirurgicală de înlocuire completă a genunchiului (RE-MODEL, RE-MOBILIZE).
În aceste studii randomizate, pacienţii supuşi intervenţiei chirurgicale elective de înlocuire completă de şold/genunchi, anticoagulantul oral dabigatran a fost cel puţin la fel de eficace ca şi enoxaparina subcutanată în prevenirea tromboembolismului venos (end-point primar) sau al decesului (p <0,0001 pentru non-inferioritate).
În studiile RENOVATE şi RE-NOVATE II dabigatranul a fost la fel de eficient şi sigur ca enoxaparina în ceea ce priveşte obiectivul primar de TEV totale şi mortalitate de toate cauzele, care au apărut la 7,7% şi 8,8% dintre pacienţi, respective (p <0,0001 pentru non-inferioritate). În ceea ce priveşte apariţia evenimentelor TEV semnificative au inclus tromboza venoasă profundă proximală, embolismul pulmonar nonfatal şi TEV complicate cu deces, diferenţa a fost de 2,2% faţă de 4,2% în grupul cu dabigatran vs. enoxaparină.
Evenimente hemoragice majore – clasificate ca fiind fatale, într-un organ critic, asociate cu o scădere de 20 mg / L a hemoglobinei – au fost comparabile între cele două grupuri de tratament, 1,4% dintre pacienţii din grupul dabigatran vs 0,9% dintre cei cărora li s-a administrat enoxaparina au avut episoade de sângerare majoră (p = 0,40).
Rezultatele ambelor studii au evidenţiat că efectul antitrombotic al dabigatranului 110 mg × 2 şi 150 mg × 2 nu au fost inferioare din punct de vedere statistic celui al enoxaparinei în ceea ce priveşte totalul TEV şi al mortalităţii de toate cauzele.
În cadrul populaţiei din studiile clinice RE-MODEL şi RE-NOVATE (5,539 pacienţi trataţi), 51% prezentau concomitent hipertensiune arterială, 9% prezentau concomitent diabet zaharat, 9% prezentau concomitent boală arterială coronariană şi 20% avuseseră în antecedente insuficienţă venoasă. Niciuna dintre aceste afecţiuni nu s-a dovedit a influenţa efectele dabigatranului de a preveni TEV sau frecvenţa sângerării.
2. Tratamentul trombembolismului venos acut (RE-COVER, RE-COVER II)18.
Studiul RE-COVER este cel mai extins program de studii care evaluează noul anticoagulant oral în tratamentul trombo-embolismului venos acut (TEV). Dabigatran etexilat cu administrare orală (150 mg de două ori pe zi), a demonstrat non-inferioritate comparativ cu tratamentul bine controlat cu warfarină în prevenţia recurenţei trombo-embolismului venos (TEV) (2,4% vs. 2,1%, odd radio 1,10 (95% CI 0,65 la 1,84), p<0,001)
Numărul de sângerări majore a fost comparabil între dabigatran etexilat (20 pacienţi, 1,6%) şi warfarină (24 pacienţi, 1,9%). Rata sângerărilor de orice natură a fost de 16,1% în grupul cu dabigatran şi de 21,9% în grupul cu warfarină.
3. Prevenţia accidentelor vasculare cerebrale şi a emboliei sistemice la pacienţi adulţi cu fibrilaţie atrială nonvalvulară (RE-LY)19-21
Dovezile clinice ale eficacităţii dabigatran etexilat au fost obţinute din studiul RE-LY (Randomized Evaluation of Long–term anticoagulant therapy), un studiu multicentric, multinaţional, pe grupuri paralele randomizate, cu două doze secretizate de dabigatran etexilat (110 mg şi 150 mg de două ori pe zi) comparativ cu un administrarea deschisă de warfarină la pacienţi cu fibrilaţie atrială cu risc moderat până la crescut de AVC şi embolie sistemică (scor mediu CHADS de 2,1). Criteriul de evaluare final principal al acestui studiu a fost să se detemine dacă dabigatran etexilat a fost non-inferior warfarinei în reducerea incidenţei AVC şi a emboliei sistemice.
După o durată medie de urmărire de 2 ani, ambele doze de dabigatran s-au dovedit non-inferioare warfarinei, obiectivul primar al studiului, accidentul vascular cerebral sau embolia sistemică apărând la 1.69% / an, cu warfarina, comparativ cu 1,53% / an, cu dabigatran 110 mg de două ori pe zi [risc relativ (RR) 0,91; interval de încredere 95% (CI) 0,74-1,11] şi 1,11% / an, cu doza de dabigatran 150 mg × 2/zi (RR 0.66, CI 0.53-0,82). Ratele de sângerare majoră au fost similare în rândul pacienţilor privind warfarina (3,36% / an), precum şi cele privind dabigatran 150 mg × 2/zi (3.11% / an, P = 0.31), în timp ce hemoragia a fost mai puţin frecventă la pacienţii cu doze mici de dabigatran (2,71% / an, P = 0.003 pentru dabigatran 110 mg × 2/zi în raport cu warfarina). Accidentele vasculare cerebrale hemoragice au fost mai puţin frecvente, cu ambele doze de dabigatran, comparativ cu warfarina (0,38% / an la pacienţii trataţi cu warfarină, comparativ cu 0,12% / an (P, 0,001) şi 0,10% / an (P, 0,001) la pacienţii trataţi cu 110 şi 150 mg × 2/zi dabigatran). În schimb, sângerare gastro-intestinală a fost mai frecventă cu dabigatran 150 mg × 2/zi (1,51% / an) comparativ cu warfarina (1,02% / an, P, 0,001), însă aceasta nu a fost statistic diferită comparand warfarina şi 110 mg × 2/zi dabigatran. În plus, dabigatran 150 mg × 2 a scăzut mortalitatea de toate cauzele (3,6 faţă de 4,1% / an, comparativ cu warfarina, P = 0,051).
Pentru pacienţii repartizaţi randomizat pentru a li se administra warfarină, procentul mediu al timpului de încadrare în limitele terapeutice (INR 2-3) a fost de 64,4%.
Studiul RE-LY a demonstrat că dabigatran etexilat, în doză de 110 mg administrată de două ori pe zi este non-inferior warfarinei în prevenţia AVC şi a emboliei sistemice la pacienţi cu fibrilaţie atrială, cu risc redus de hemoragie intracraniană, de hemoragii totale şi de sângerări majore. Doza de 150 mg administrată de două ori pe zi reduce semnificativ riscul de accident vascular cerebral ischemic şi hemoragic, deces de cauză vasculară, hemoragii intracraniene, sângerări totale comparativ cu warfarina. Incidenţele sângerărilor majore la administrarea acestei doze au fost comparabile cu warfarina. Incidenţele infarctului miocardic au fost uşor crescute în cazul dabigatran etexilat 110 mg administrat de două ori pe zi şi 150 mg de două ori pe zi comparativ cu warfarina (risc relativ 1,29: p=0,0929 şi, respectiv risc relativ 1,27; p=0,1240).
Pe baza rezultatelor studiului RE-LY, care a arătat că dabigatran etexilat a fost noninferior cu warfarina la o doză mai mică şi superioară la una mai mare pentru prevenirea accidentului vascular cerebral tromboembolice în FA paroxistică sau permanentă, Food and Drug Administration a aprobat pe 20 septembrie 2010, ca dabigatran etexilat să fie utilizat pentru prevenirea accidentului vascular cerebral la pacienţii cu AF.
4. Prevenţia secundară a trombembolismului venos (RE-MEDY, RE-SONATE)
În RE-MEDY, aproape 3000 de pacienţi cu TEV au primit trei până la 12 luni de anticoagulare, au fost randomizaţi, cu un design dublu-orb, cu administrarea dabigatran 150 mg de două ori pe zi sau warfarină (pentru a menţine INR de 2,0-3,0) pe o perioadă suplimentară de şase până la 36 de luni, iar dabigatran a demonstrat noninferioritate la warfarină, cu sângerări mai puţine, însă au existat mai multe evenimente coronariene acute în grupul dabigatran decât la cei care warfarină (0,9% vs 0,2%). Date similare privind riscul crescut de infarct miocardic au fost constatate şi în studiul RE-LY.
RE-SONATE, un alt studiu ce utilizează dabigatran pentru prevenţia secundară a trombembolismului venos, compară de această dată dabigatran 150 mg de două ori pe zi cu placebo pentru o perioadă de şase luni până la 18 luni de anticoagulare (studiu similar cu studiul EINSTEIN – Oral Direct Factor Xa Inhibitor Rivaroxaban in Patients With Acute Symptomatic Deep-Vein Thrombosis or Pulmonary Embolism – cu rivaroxaban) şi arată că nu au existat diferenţe între grupurile de tratament în ceea ce priveşte evenimentele coronariene. TEV recurent a avut loc în trei (0,4%) din 681 pacienţi trataţi cu dabigatran şi 37 (5,6%) din cei trataţi cu placebo (HR 0,08; p <0,0001).
Au fost doi pacienţi cu sângerări majore la dabigatran, comparativ cu niciunul cu placebo, o diferenţă care nu a fost semnificativă. Sângerarea relevantă clinic a fost de trei ori mai crescută în grupul cu dabigatran – 36 pacienţi (5,3%) comparativ cu 12 (1,8%) care au luat placebo (HR 2,9, p = 0,001). Evenimentele cardiovasculare au fost observate la trei pacienţi care au primit dabigatran (0,4%), comparativ cu doi pacienţi care au primit placebo (0,3%), o diferenţă nesemnificativă.
5. Prevenţia secundară a evenimentelor cardiovasculare la pacienţii cu sindrom coronarian acut (RE-DEEM) (RandomizEd Dabigatran Etexilate Dose Finding Study in Patients With Acute Coronary Syndromes Post Index Event With Additional Risk Factors for Cardiovascular Complications Also Receiving Aspirin and Clopidogrel)22
Dabigatran etexilat a fost evaluat în studiul de faza II, RE-DEEM în prevenţia secundară a evenimentelor cardiovasculare la pacienţii cu sindrom coronarian acut în scopul de a determina dacă asocierea dabigatranului la terapia antiagregantă plachetară reduce ischemia miocardică.
În studiul RE-DEEM, administrarea dabigatranului de două ori pe zi, timp de 6 luni, versus placebo, la pacienţii trataţi cu dublă terapie antiplachetară după un sindrom coronarian acut, numărul de evenimente coronariene în braţul de studiu cu dabigatran 110 mg şi 150 mg nu a fost mai mare decât în grupul placebo şi nici la pacienţii cărora li s-au administrat doze mai mici de dabigatran22.
Este neclar dacă alte studii de fază III vor fi efectuate pentru această indicaţie, însă acestea nu au fost încă iniţiate, cel mai probabil datorită ameninţării inerente de hemoragie majoră cu tripla terapie.
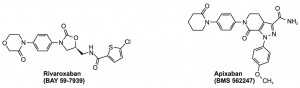
Figura 3. Formula chimică a rivaroxabanului şi apixabanului.
DABIGATRANUL ŞI RISCUL DE SINDROAME CORONARIENE ACUTE
O metaanaliză publicată în Archives of Internal Medicine în ianuarie 2012 a trialurilor randomizate care au comparat dabigatranul cu diverse alte anticoagulante (warfarina, enoxaparina) sau placebo a arătat că acesta creşte riscul de infarct miocardic sau sindroame coronariene acute în general34. Cu toate că dabigatranul a determinat o creştere cu 33% a riscului relativ de infarct miocardic, creşterea în riscul absolut este foarte mică, de 0,27%. În metaanaliza realizată, ponderea cea mai mare în dovedirea faptului că dabigatranul a fost asociat cu un risc crescut de infarct miocardic o are studiul RE-LY, care este şi cel mai mare dintre ele.
Nu se cunosc mecanismele farmacologice prin care dabigatranul creşte riscul de sindroame coronariene acute. Diverse căi de elucidare a acestei dileme, vin din experienţa cu alte anticoagulante orale. De exemplu, ximelagatranul, deşi determină scăderea evenimentelor cardiovasculare, s-a demonstrat că el creşte markerii inflamatorii35. Astfel, că un membru al aceleiaşi clase, dabigatranul poate avea efecte de agravare a aterosclerozei şi a complicaţiilor aterotrombotice. Nu s-a găsit nimic similar pentru inhibitorii factorului Xa, apixaban sau rivaroxaban la pacienţii cu fibrilaţie atrială.
De asemenea, dacă medicamentul comparator din aceste studii randomizate avea ca efect de prevenire a infarctului miocardic, efect pe care dabigatranul nu îl are, atunci aceste e normal să fie asociat cu un risc mai mare de infarct miocardic34. Warfarina, care şi-a demonstrat eficienta în reducerea incidenţei infarctului miocardic atât în monoterapie cât şi în asociere cu aspirina, a fost folosită în multe dintre studiile incluse în metaanaliza recent publicată. Totuşi, dabigatranul poate să nu determine direct creşterea incidenţei infarctului miocardic, ci poate să îi lipsească efectul benefic al warfarinei sau aspirinei în prevenţia infarctului34.
Aspirina sau alte antiplachetare pot determina reducerea riscului de infarct miocardic, fiind astfel important dacă pacienţii incluşi în diverse studii au primit similar terapie antiplachetară. Totuşi, nu se consideră că acest aspect ar fi răspunzător de diferenţele înregistrate34.
B. RIVAROXABAN
Rivaroxabanul este un inhibitor direct de factor Xa care pare a avea un efect anticoagulant mai consistent şi mai predictibil decât warfarina27.
Rivaroxabanul se absoarbe repede, cu o concentraţie plasmatică maximă la 2-4 ore după administrare. Biodisponibilitatea sa este redusă la doze mai mari, probabil datorită solubilităţii slabe a acestuia. Totuşi, biodisponibilitatea dozei curent utilizate de 10 mg este de 80-100% şi nu este influenţată mult de alimentaţie. Nu s-a înregistrat nici un efect de acumulare indiferent de doza administrată29.
Rivaroxabanul este metabolizat de CYP450, în special de CYP3A4, care este puternic inhibat de ketoconazol şi ritonavir, aceste medicamente putând creşte mult nivelul plasmatic al rivaroxabanului. S-au descris mici interacţiuni între rivaroxaban şi aspirină sau naproxen, dar nu s-a evidenţiat nicio interacţiune cu digoxinul29.
Eliminarea rivaroxabanului se face pe două căi: 1/3 se elimină renal nemodificat, iar 2/3 se elimină după metabolizare hepatică la produşi inactivi, timpul de injumatăţire este de aproximativ 7-11 ore29.
Dovezile legate de eficienţa şi siguranţa rivaroxabanului în prevenţia complicaţiilor trombo-embolice vin din diverse trialuri randomizate (EINSTEIN, ROCKET-AF, ATLAS ACS 2–TIMI 51)25,28.
S-a demonstrat că rivaroxabanul este mai eficient decât enoxaparina în prevenţia trombembolismului venous la pacienţii care suferă o intervenţie chirurgicală ortopedică23,24.
În trialul EINSTEIN (Oral Direct Factor Xa Inhibitor Rivaroxaban in Patients With Acute Symptomatic Deep-Vein Thrombosis or Pulmonary Embolism) rivaroxabanul a dovedit a fi noninferior enoxaparinei urmată de administrarea de warfarină pentru o perioadă de 3, 6 sau 12 luni la pacienţii cu tromboză venoasă acută (endpoint primar 2,1% – rivaroxaban vs 3% – enoxaparina-warfarina, P <0,0001)25. Nu au existat diferenţe semnificative între cele două grupuri în ceea ce priveşte riscul de sângerare.
Trialul ROCKET-AF (An Efficacy and Safety Study of Rivaroxaban With Warfarin for the Prevention of Stroke and Non-Central Nervous System Systemic Embolism in Patients With Non-Valvular Atrial Fibrillation) a avut ca obiectiv principal demonstrarea noninferiorităţii rivaroxabanului în prevenirea accidentului vascular cerebral şi a emboliilor sistemice faţă de tratamentul cu warfarină27. Endpoint-ul primar s-a înregistrat la 1,7%/an în grupul cu rivaroxaban şi la 2,2%/an în grupul cu warfarină (P <0,001), reieşind de aici noninferioritatea inhibitorului de factor Xa. Nu s-au înregistrat diferenţe importante în incidenţa sângerărilor majore între cele două grupuri (14,9%/an – rivaroxaban şi 14,5%/an warfarina, P=0,44), deşi în grupul cu rivaroxaban s-a observat o reducere semnificativă a hemoragiilor intracraniene şi hemoragiilor fatale (0,2% vs 0.5%, P=0,0003)27.
Un studiu recent, ATLAS ACS 2–TIMI 51(Rivaroxaban in Combination With Aspirin Alone or With Aspirin and a Thienopyridine in Patients With Acute Coronary Syndromes) utilizează doze mici de rivaroxaban (2,5 mg sau 5 mg) pe termen lung (13-31 luni) la pacienţii cu sindroame coronariene acute recente în asociere cu terapia standard. Rivaroxabanul a determinat reducerea endponitului composit primar (deces de cauză cardiovasculare, infarct miocardic sau accident vascular cerebral) cu 8,9% faţă de 10,7% doar cu terapia standard (p=0,008). Totuşi, în comparaţie cu placebo, rivaroxabanul a crescut frecvenţa hemoragiilor majore nelegate de bypass-ul aortocoronarian (2,1% vs 0,6%, P <0,001) şi frecvenţa hemoragiilor intracraniene (0,6% vs 0,2%, P=0,009). Nu s-a observat nicio diferenţă semnificativ statistică între cele două grupuri în ceea ce priveşte hemoragiile fatale (0,3% vs 0,2%, P=0,66)28.
Astfel, rivaroxabanul şi-a dovedit efectele benefice în diverse situaţii clinice şi devine un competitor important al AVK.
C. APIXABAN
Apixabanul este un inhibitor direct şi reversibil al factorului Xa, înalt selectiv. Farmacocinetica apixabanului este grevată de o absorbţie intestinală rapidă şi de un timp de înjumătăţire de aproximativ 12 ore. Eliminarea din organism se face fie prin excreţie renală directă (25%), fie prin metabolizare hepatică la un compus stabil şi hidrofil (O-demetil apixaban sulfat)33.
Studiile efectuate cu apixabanul au avut ca scop preventia trombozei venoase profunde la pacienţii severi (trialul ADOPT (Study of Apixaban for the Prevention of Thrombosis-related Events in Patients With Acute Medical Illness) şi prevenţia accidentelor vasculare embolice (sistemice sau cerebrale) la pacienţii cu fibrilaţie atrială (trialul ARISTOTLE (Apixaban for the Prevention of Stroke in Subjects With Atrial Fibrillation)30-32.
Primele date despre eficienţa apixabanului vin dintr-un studiu care a inclus pacienţi cu fibrilaţie atrială care nu erau candidaţi pentru terapia cu AVK şi în care s-a comparat eficienţa administrării de apixaban faţă de aspirină în prevenţia accidentului vascular cerebral. Tratamentul cu apixaban a determinat o reducere a emboliilor sistemice şi cerebrale cu 55% faţă de tratamentul cu aspirină, fără a determina creşterea riscului de hemoragii majore30.
Trialul ARISTOTLE este un studiu randomizat, dublu orb care a comparat eficienţa apixabanului la o doză de 5 mg × 2/zi faţă de warfarină în prevenţia accidentului vascular cerebral la pacienţii cu fibrilaţie atrială şi cu cel putin un factor de risc pentru complicaţii embolice. După o perioadă medie de urmărire de aproximativ 1,8 ani, endpointul composit primar (accident vascular cerebral ischemic sau hemoragic sau embolie sistemică) s-a înregistrat la 1,27%/an în grupul de pacienţi trataţi cu apixaban şi la 1,6%/an în grupul de pacienţi trataţi cu warfarina (P <0,001). Această eficienţă s-a dovedit a fi dublată de o siguranţă în ceea ce priveşte riscul hemoragic, rata hemoragiilor majore fiind de 2,13%/an în grupul cu apixaban faţă de 3,09% în grupul cu warfarina (P <0,001). De asemenea, tratamentul cu apixaban a determinat o reducere a mortalităţii de orice cauză (3,52% vs 3,94%, P=0,047). Astfel, concluzia este că la pacienţii cu fibrilaţie atrială, apixabanul este superior warfarinei în prevenirea accidentului vascular cerebral şi emboliilor sistemice, cu un risc mai scăzut de sângerare şi cu o reducere a mortalităţii de orice cauză31.
În trialul ADOPT s-a comparat eficienţa apixabanului faţă de enoxaparină în prevenirea complicaţiilor tromboembolice la pacienţii critici, cu insuficienţă cardiacă congestivă sau insuficienţă respiratorie şi cu minim un factor de risc pentru tromboză venoasă profundă. S-a administrat fie apixaban 2,5 mg × 2/zi pentru 30 de zile, fie enoxaparina 40 mg/zi pentru 6-14 zile. Endpointul primar a fost unul compozit care a evaluat mortalitatea la 30 de zile legată de complicaţii trombembolice, incidenţa trombozei venoase profunde şi trombembolism pulmonar. Endpointul primar a fost decelat la 3,06% în grupul cu enoxaparina şi la 2,71% în grupul cu apixaban (p=0,44), ceea ce arăta faptul că tratamentul cu apixaban nu e superior administrării de enoxaparină în prevenţia complicaţiilor tromboembolice la pacienţii critici. Pe lângă aceasta, apixabanul a crescut semnificativ incidenţa hemoragiilor majore faţă de enoxaparina (0,47% vs 0,19%, P=0,04)32.
În prezent, dabigatran a primit aprobarea EMA (European Medicines Agency) şi FDA (Food and Drug Administration) pentru cele două indicaţii:
– prevenţia primară a tromboembolismului venos la pacienţii cu intervenţii ortopedice majore (protezare) – EMA (aprobare obtinuţă în august 2008) şi
– prevenţia AVC la pacienţii cu fibrilaţie atrială non-valvulară – EMA (aprobare obţinută 1 august 2011), FDA (aprobare obtinuţă în 19 octombrie 2010).
CONCLUZII
În prezent, mai multe anticoagulante pe cale orală au fost testate cu succes în tratamentul şi prevenirea TEV, precum şi pentru prevenirea accidentului vascular cerebral la pacienţii cu FA non-valvulară.
Întrucât aceste noi anticoagulante orale oferă promisiunea de confort, multe întrebări rămân legate de utilizarea acestora în condiţii de siguranţă şi punerea în aplicare în practica clinică. Deşi administrarea noilor anticoagulante orale nu necesită monitorizare de rutină a coagulării, există anumite situaţii clinice în care monitorizarea funcţiei renale şi cunoaşterea gradului de anticoagulare este necesar pentru îngrijirea pacientului eficientă şi sigură.
Noile anticoagulante orale prezintă calităţi apropiate de cele ale anticoagulantelor ideale, calităţi evidenţiate în trialuri şi studii încă în desfăşurare, însă în prezent indicaţiile lor de ghid sunt limitate.
Conflict de interese: niciunul.
Bibliografie
1. Oger E. Incidence of venous thromboembolism: a community-based study in Western France. Thromb Haemost. 2000; 83:657-60.
2. Spencer FA, Emery C, Lessard D et al. The Worcester Venous Thromboembolism study: a population-based study of the clinical epidemiology of venous thromboembolism. J Gen Intern Med. 2006; 21:722-7.
3. Brass L, Krumholz L, Scinto J et al. Warfarin use following ischemic stroke among Medicare patients with atrial fibrillation. Arch Intern Med. 1998; 158:2093-100.
4. John W. Eikelboom and Jeffrey I. Weitz. New Anticoagulants. Circulation 2010;121;1523-1532
5. Graeme J. Hankey and John W. Eikelboom. Dabigatran Etexilate: A New Oral Thrombin Inhibitor. Circulation 2011;123;1436-14509.
6. Go AS, Hylek EM, Chang Y, Phillips KA, Henault LE, Capra AM, Jensvold NG, Selby JV, Singer DE. Anticoagulation therapy for stroke prevention in atrial fibrillation: how well do randomized trials translate into clinical practice? JAMA. 2003;290:2685–2692.
7. Nieuwlaat R, Capucci A, Camm AJ, Olsson SB, Andresen D, Davies DW, Cobbe S, Breithardt G, Le Heuzey JY, Prins MH, Lévy S, Crijns HJ; European Heart Survey Investigators. Atrial fibrillation management: a prospective survey in ESC member countries: the Euro Heart Survey on Atrial Fibrillation. Eur Heart J. 2005;26:2422–2434.
8. Birman-Deych E, Radford MJ, Nilasena DS, Gage BF. Use and effectiveness of warfarin in Medicare beneficiaries with atrial fibrillation. Stroke. 2006;37:1070–1074
9. Jan Steffel and Eugene Braunwald. Novel oral anticoagulants: focus on stroke prevention and treatment of venous thrombo-embolism. European Heart Journal (2011) 32, 1968–1976
10. Steffel J, Luscher TF. Novel anticoagulants in clinical development: focus on factor Xa and direct thrombin inhibitors. J Cardiovasc Med (Hagerstown, MD) 2009;10:616–623.
11. Stangier J, Rathgen K, Stahle H, Gansser D, RothW. The pharmacokinetics, pharmacodynamics and tolerability of dabigatran etexilate, a new oral direct thrombin inhibitor, in healthy male subjects. Br J Clin Pharmacol 2007;64:292–303.
12. Stangier J. Clinical pharmacokinetics and pharmacodynamics of the oral direct thrombin inhibitor dabigatran etexilate. Clin Pharmacokinet 2008;47:285–295.
13. Ansell J, Hirsh J, Hylek E et al. Pharmacology and management of the vitamin K antagonists: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines (8th edition). Chest. 2008; 133(suppl):160S-198S.
14. Rudd KM, Dier JG. Comparison of two different models of anticoagulation services with usual medical care.Pharmacotherapy. 2010; 30:330–8.
15. Weitz JI, Hirsh J, Samama MM. New antithrombotic drugs: American College of Chest Physicians evidence-based clinical practice guidelines (8th edition). Chest. 2008;133:234S–256S.
16. Eriksson BI, Dahl OE, Huo MH, Kurth AA, Hantel S, Hermansson K, Schnee JM, Friedman RJ. Oral dabigatran versus enoxaparin for thromboprophylaxis after primary total hip arthroplasty (RE-NOVATE II). A randomised, double-blind, noninferiority trial. Thromb Haemost 2011;105.
17. Eriksson BI, Dahl OE, Rosencher N, Kurth AA, van Dijk CN, Frostick SP, Kalebo P, Christiansen AV, Hantel S, Hettiarachchi R, Schnee J, Buller HR. Oral dabigatran etexilate vs. subcutaneous enoxaparin for the prevention of venous thromboembolism after total knee replacement: the RE-MODEL randomized trial. J Thromb Haemost 2007;5:2178–2185
18. Sam Schulman, M.D., Clive Kearon, M.D., Ajay K. Kakkar, M.D., Patrick Mismetti, M.D., Sebastian Schellong, M.D., Henry Eriksson, M.D., David Baanstra, M.Sc., Janet Schnee, M.D., and Samuel Z. Goldhaber, M.D. for the RE-COVER Study Group. Dabigatran versus Warfarin in the Treatment of Acute Venous Thromboembolism. N Engl J Med 2009; 361:2342-2352
19. Ezekowitz MD, Connolly S, Parekh A, Reilly PA, Varrone J, Wang S, Oldgren J, Themeles E, Wallentin L, Yusuf S. Rationale and design of RE-LY: randomized evaluation of long-term anticoagulant therapy, warfarin, compared with dabigatran. Am Heart J. 2009;157:805– 810.
20. Connolly SJ, Ezekowitz MD, Yusuf S, Eikelboom J, Oldgren J, Parekh A, Pogue J, Reilly PA, Themeles E, Varrone J, Wang S, Alings M, Xavier D, Zhu J, Diaz R, Lewis BS, Darius H, Diener H-C, Joyner CD, Wallentin L; RE-LY Steering Committee and Investigators. Dabigatran versus warfarin in patients with atrial fibrillation. N Engl J Med. 2009;361:1139–1151.
21. Connolly SJ, Ezekowitz MD, Yusuf S, Reilly PA, Wallentin L; Randomized Evaluation of Long-Term Anticoagulation Therapy Investigators. Newly identified events in the RE-LY trial [letter to the editor].N Engl J Med. 2010;363:1875–1876.
22. Stiles S. Oral anticoagulants REDEEMed? Daily dabigatran “safe” with dual antiplatelets after MI. http://www.theheart.org/article/1026791.do. Accessed September 24, 2010.
23. Eriksson BI, Borris LC, Friedman RJ, et al. Rivaroxaban versus enoxaparin for thromboprophylaxis after hip arthroplasty. N Engl J Med 2008;358:2765-75.
24. Lassen MR, Ageno W, Borris LC, et al. Rivaroxaban versus enoxaparin for thromboprophylaxis after total knee arthroplasty. N Engl J Med 2008;358:2776-86.
25. The EINSTEIN Investigators. Oral rivaroxaban for symptomatic venous thromboembolism. N Engl J Med 2010;363:2499-510.
26. ROCKET AF Study Investigators. Rivaroxaban — once daily, oral, direct factor Xa inhibition compared with vitamin K antagonism for prevention of stroke and Embolism Trial in Atrial Fibrillation: rationale and design of the ROCKET AF study. Am Heart J 2010;159(3):340.e1-347.e1.
27. Patel MR, Mahaffey KW, Garg J, Pan G, Singer DE, et all; ROCKET AF Investigators. Rivaroxaban versus warfarin in nonvalvular atrial fibrillation. N Engl J Med. 2011 Sep 8;365(10):883-91.
28. Mega JL, Braunwald E, Wiviott SD, Bassand JP, et all; ATLAS ACS 2–TIMI 51 Investigators. Rivaroxaban in patients with a recent acute coronary syndrome, N Engl J Med. 2012 Jan 5;366(1):9-19.
29. E. Perzborn, S. Roehrig, A. Straub, D. Kubitza, F. Misselwitz, The discovery and development of rivaroxaban, an oral, direct factor Xa inhibitor, Nature Reviews Drug Discovery, 2010
30. Connolly SJ, Eikelboom J, Joyner C, et al. Apixaban in patients with atrial fibrillation. N Engl J Med 2011;364:806-17.
31. Granger CB, Alexander JH, McMurray JJ, Lopes RD, Hylek EM, et all; ARISTOTLE Committees and Investigators. Apixaban versus warfarin in patients with atrial fibrillation, N Engl J Med. 2011 Sep 15;365(11):981-92
32. Goldhaber SZ, Leizorovicz A, Kakkar AK, Haas SK, Merli G, Knabb RM, Weitz JI; ADOPT Trial Investigators, Apixaban versus enoxaparin for thromboprophylaxis in medically ill patients, N Engl J Med. 2011 Dec 8;365(23):2167-77.
33. Raghavan N, Frost CE, Yu Z, He K, Zhang H, et all, Apixaban metabolism and pharmacokinetics after oral administration to humans, Drug Metab Dispos. 2009 Jan;37(1):74-81.
34. Uchino K, Hernandez AV, Dabigatran Association With Higher Risk of Acute Coronary Events: Meta-analysis of Noninferiority Randomized Controlled Trials, Arch Intern Med. 2012 Jan 9.
35. Christersson C, Oldgren J, Wallentin L, Siegbahn A. Treatment with an oral direct thrombin inhibitor decreases platelet activity but increases markers of inflammation in patients with myocardial infarction. J Intern Med. 2011;270(3):215-223.
36. Mincu Raluca-Ileana, Iancu Mădălina-Elena, Corlan A., Pîrvu O. Interacţiunea între diuretice şi medicaţia anticoagulantă orală. Revista Romana de Cardiologie 2009;24:1-4
37. Doina Dimulescu. Terapia antitrombotică în sindroamele coronariene acute. Progrese in Cardiologie;2006:59-77
 This work is licensed under a
This work is licensed under a