Ileana Ţepeş Piser Macarie, C. Macarie
Articol primit la data de 26 ianuarie 2012. Articol acceptat la data de 11 februarie 2012.
1 Institutul de Urgenţă pentru Boli Cardiovasculare „Prof. Dr. C.C.Iliescu” Bucureşti
Ileana Ţepeş Piser Macarie – Institutul de Urgenţă pentru Boli Cardiovasculare „Prof. Dr. C.C.Iliescu”, Şoseaua Fundeni 258, sector 2, CP 022328, Bucureşti
Rezumat: Fibrilaţia atrială (FA) este cea mai frecventă aritmie constatată la pacienţii cu insuficienţă cardiacă (IC); în ciuda consecinţelor hemodinamice negative, influenţa prognostică a FA la pacienţii cu IC rămâne deocamdată controversată. Scopul lucrării – evaluarea prevalenţei FA într-o populaţie de pacienţi internaţi cu diagnosticul de insuficienţă cardiacă cu fracţie de ejecţie scăzută (ICFES) clasele III şi IV NYHA; evidenţierea caracteristicilor epidemiologice, clinice şi de tratament ale pacienţilor cu ICFES şi FA în comparaţie cu cele ale pacienţilor în ritm sinusal (RS); evaluarea asocierii dintre FA şi mortalitatea generală la acest grup de pacienţi. Material şi metodă – Este un studiu retrospectiv care a înrolat 882 de pacienţi internaţi consecutiv, în secţia Cardiologie I a Institutului de Urgenţă pentru Boli Cardiovasculare “Prof. Dr. C.C.Iliescu” cu diagnosticul principal de ICFES clasele III şi IV NYHA, în perioada 01.01.2004 – 31.10.2007. În funcţie de prezenţa FA, lotul global a fost împărţit în sublotul în FA şi sublotul în RS. Analiza datelor a folosit metode ale statisticii descriptive, analiza de supravieţuire Kaplan-Meier, compararea ratelor de deces. Pragul “p” de semnificaţie statistică a fost sub 0,05. Contribuţia independentă a fiecăruia dintre factorii asociaţi cu mortalitatea la distanţă în analiza univariată a fost apreciată ulterior prin analiza multivariată prin modelul de regresie a riscului proporţional (Cox). Perioada medie de urmărire a fost de cca 30 de luni. Rezultate – Fibrilaţia atrială a fost prezentă la 31,5% dintre pacienţi. Pacienţii cu ICFES au fost în majoritate bărbaţi atât la nivelul lotului global (71,2% B vs 28,8% F) cât şi la nivelul subloturilor (77% B vs 23% F) FA, respectiv (68,5% B vs 31,5% F) RS. Pacienţii în FA comparativ cu cei în RS erau mai vârstnici (65,6 ani vs 62,8 ani; p=0,002), au avut procentul consumatorilor de alcool mai crescut (15,1% vs 6,6%; p=0,002), frecvenţa cardiacă mai mare (81,47 bpm vs 75,15 bpm; p <0,001), AS mai dilatat (55,04 mm vs 50,70 mm; p<0,001), nivelurile creatininei sanguine mai ridicate (1,85 mg/dl vs 1,20 mg/dl; p=0.004), etiologia IC a fost mai frecvent nonischemică (62,9% vs 49,8%; p<0,001) şi au avut multiple comorbidităţi. Rata generală a deceselor pacienţilor cu ICFES la sfârşitul perioadei de urmărire a fost de 41,5%. Rata specifică de deces la pacienţii cu FA a fost semnificativ mai mare decât a celor în RS (47,5% vs. 38,7%; p<0,05). Analiza multivariată a evidenţiat contribuţia FA la creşterea mortalităţii de orice cauză (HR 1,257; 95% CI 1,012-1,560; p=0,03). La pacienţii cu FEVS sub 25%, FA îşi pierde funcţia de factor independent de prognostic pentru mortalitatea de toate cauzele. Concluzii – FA s-a dovedit a fi un factor independent de prognostic pentru excesul de mortalitate la pacienţii cu IC cu disfuncţie sistolică moderat/severă.
Cuvinte-cheie: fibrilaţia atrială, insuficienţă cardiacă cu fracţie de ejecţie scăzută, prognostic.
Summary: Atrial fibrillation (AF) is the most common arrhythmia in patients with heart failure (HF); despite its negative hemodynamic consequences, the prognostic influence of AF in patients with HF remains controversial. The aims of the paper – To evaluate the atrial fibrillation prevalence in a population of patients hospitalized for heart failure with reduced ejection fraction (HFREF) who were in NYHA III and IV functional classes. To emphasize the clinical, epidemiological and treatment characteristics of patients with heart failure and reduced ejection fraction and AF and to compare them to those in sinus rhythm (SR); To evaluate the association between AF and general mortality in this group of patients. Materials and methods – It is a retrospective study that enrolled 882 consecutive hospitalized patients between 1.01.2004 and 31.10.2007 in the Cardiology I Department from “C.C. Iliescu” Institute of Emergency of Cardiovascular Diseases, having as main diagnosis HFREF in III and IV NYHA functional classes. Depending on the AF presence, the entire group has been divided in the subgroup with AF and in the subgroup with SR. The data analysis used descriptive statistics methods, Kaplan-Meier survival analysis, death rates comparison. The statistical significance of the p value threshold was below 0.05. The independent contribution of each of the associated factors with the out of hospital mortality when using the unvaried analysis was later appreciated through multivariate analysis using the regression model of the proportional risk (Cox). The mean follow-up period was approximately 30 months. Results – The AF was present in 31.5% of the patients at enrolment stage. Patients with HFREF were mostly men not only within the general group of patients (71.2% M vs 28.8% F), but also within the AF subgroup (77% M vs 23% F) and within SR subgroup respectively (68.5% M vs 31.5% F). The patients in AF, compared to those in SR, were older (65.6 years vs 62.8 years; p=0.002), had a higher percentage of alcohol consumers (15.1% vs 6.6%; p=0.002), had higher cardiac frequency (81.47 bpm vs 75.15 bpm; p<0.001), more dilated LA (55.04 mm vs 50.7 mm; p<0.001), higher levels of blood creatinine (1.85 mg/dl vs 1.20 mg/dl; p=0.004), the HF etiology was most frequent non-ischemic (62.9% vs 49.8%; p<0.001), and also had multiple co-morbidities. The general death rate of patients with HFREF at the end of the follow-up period was 41.5%. The specific death rate in patients with AF was significantly higher compared with those in SR (47.5% vs. 38.7%; p<0.05). The multivariate analysis emphasized the AF contribution to the increase of all-cause mortality (HR 1.257; 95% CI 1.012-1.560; p=0.03). In patients with left ventricle ejection fraction below 25%, the AF loses its function of prognostic independent factor for all-cause mortality. Conclusions – AF was proven to be an independent prognostic factor for the excess of mortality in patients with HF and moderate / severe systolic dysfunction.
Keywords: atrial fibrillation, heart failure with reduced ejection fraction, prognosis.
Lista cu prescurtări
ACO anticoagulante orale
AS atriul stâng
AV alură ventriculară
AVC accident vascular cerebral
BB betablocant
BPOC bronhopneumopatie obstructivă cronică
CI interval de încredere
DTDVS diametru telediastolic al ventriculului stâng
DTSVS diametru telesistolic al ventriculului stâng
FA fibrilaţie atrială
FE fracţie de ejecţie
FEs45 fracţie de ejecţie sub 45%
HR rata de hazard
HTA hipertensiune arterială
HVS hipertrofie ventricul stâng
ICFES insuficienţă cardiacă cu fracţie de ejecţie scăzută
IECA inhibitorii enzimei de conversie ai angiotensinei
PTDVS presiune telediastolică a ventriculului stâng
RS ritm sinusal
TAD tensiune arterială diastolică
TAS tensiune arterială sistolică
CHARM Candesartan in Heart Failure Assessment of Reduction in Mortality and Morbidity
COACH Coordinating Study Evaluating Outcomes of Advising and Counseling in Heart Failure.
COMET Carvedilol Or Metoprolol European Trial
DIAMOND Danish Investigations of Arrhythmia and Mortality on Dofetilide
EHF Euro Heart Failure Survey
SOLVD Studies Of Left Ventricular Dysfunction
VALIANT Valsartan In Acute Myocardial Infarction Trial
INTRODUCERE
Fibrilaţia atrială (FA) şi insuficienţa cardiacă (IC) sunt două epidemii ale bolilor cardiovasculare ale secolului al XXI-lea1. FA este cea mai frecventă aritmie la pacienţii cu IC, iar prevalenţa sa creşte odată cu severitatea acesteia, putând varia de la 10% la 50%2-4. Influenţa prognostică a FA asupra pacienţilor cu IC rămâne încă subiect de controversă.
SCOPUL LUCRăRII
Obiectivele acestei lucrări au fost: evaluarea prelevanţei FA într-o populaţie de pacienţi cu insuficienţă cardiacă cu fracţie de ejecţie a VS scăzută (ICFES), în clasele funcţionale III şi IV NYHA; evidenţierea caracteristicilor epidemiologie, clinice şi terapeutice ale acestora în comparaţie cu cele ale pacienţilor în ritm sinusal; determinarea factorilor predictivi pentru mortalitate în lotul global şi pe subloturi; evaluarea asocierii dintre FA şi mortalitate la această categorie de pacienţi.
MATERIAL ŞI METODĂ
Lucrarea reprezintă un studiu retrospectiv de cohortă efectuat pe 882 pacienţi (278 în FA, 604 în RS) din baza de date a Institutului de Urgenţă pentru Boli Cardiovasculare “Prof Dr. C.C.Iliescu”, internaţi consecutiv în Secţia Cardiologie I în perioada ianuarie 2004 – octombrie 2007.
Criterii de includere: diagnosticul de ICFES clasa funcţională III sau IV NYHA; existenţa cel puţin a unei examinări ecocardiografice cu determinarea FEVS; existenţa cel puţin a unei înregistrări EKG efectuată în timpul spitalizării; vârsta peste 20 ani.
Criterii de excludere: valvulopatii mitrale şi aortice severe care necesitau corecţie chirurgicală; boli congenitale de cord; creatinină serică >3 mg %; pericardită; cardiomiopatia restrictivă şi obstructivă; cardiostimulare permanentă; neoplazii avansate. FEVS a fost considerată scăzută la o valoare mai mică de 45%.
Consumul de alcool s-a stabilit prin anamneză. Anemia a fost diagnosticată la valoarea hemoglobinei <12 mg/dl.
Datele epidemiologice, clinice, de laborator şi de tratament au fost înregistrate pe o fişă standard având drept sursă dosarele medicale ale pacienţilor. Timpul mediu de urmărire a fost de 30 luni (minim 18 luni, maxim 58 luni).
Pentru urmărirea la distanţă, informaţiile au fost obţinute din scrisorile adresate pacientului/medicului de familie (informaţii obţinute la 65% dintre pacienţi) şi din registrul stării civile privind decesele (informaţie obţinută la 100% pacienţi). Toate informaţiile au fost procesate în condiţii de confidenţalitate.
Prelucrarea datelor s-a efectuat atât la nivelul lotului global cât şi stratificat pe subloturi: sublotul de ICFES în FA şi sublotul cu ICFES în RS. În faza descriptivă, s-au calculat indicatori de tendinţă centrală şi dispersie, specifici caracteristicilor cantitative precum şi indicatori de distribuţie şi structură, pentru variabilele calitative. În faza analitică univariată, testarea diferenţei dintre subloturi, s-a făcut prin aplicarea testului t-Student. Pentru variabilele calitative, repartiţiile de frecvenţă au fost comparate prin testul χ2. Diferenţele au fost considerate semnificative statistic pentru un prag p <0,05. Influenţa FA asupra mortalităţii a fost evaluată cu ajutorul ratelor generale şi specifice de deces şi a curbelor de supravieţuire Kaplan Meier (KM), atât la nivel global cât şi pe subloturi.
Pentru evaluarea diferenţelor de supravieţuire dintre cele două subloturi s-a aplicat testul log-rank, la un prag de semnificaţie p <0,05. Contribuţia independentă a fiecăruia dintre factorii asociaţi cu mortalitatea în analiza univariată a fost ulterior apreciată în analiza multivariată prin modelul de regresie a riscului proporţional (Cox). Modelul a selecţionat factorii de prognostic favorabili când HR<1 şi defavorabil când HR>1 Pentru procesarea datelor s-a utilizat pachetul de programe EpiInfo.
REZULTATE
Caracteristicile pacienţilor cu ICFES
Lotul global cuprinde 882 pacienţi, împărţiţi în două subloturi: pacienţi cu FA 278 (31,5%) şi sublotul de pacienţi în RS 604 (68,5%).
Caracteristicile demografice, clinice şi de laborator ale pacienţilor studiaţi sunt prezentate în Tabelul 1A.
Tabelul 1A. Caracteristicile demografice, clinice şi de laborator ale pacienţilor
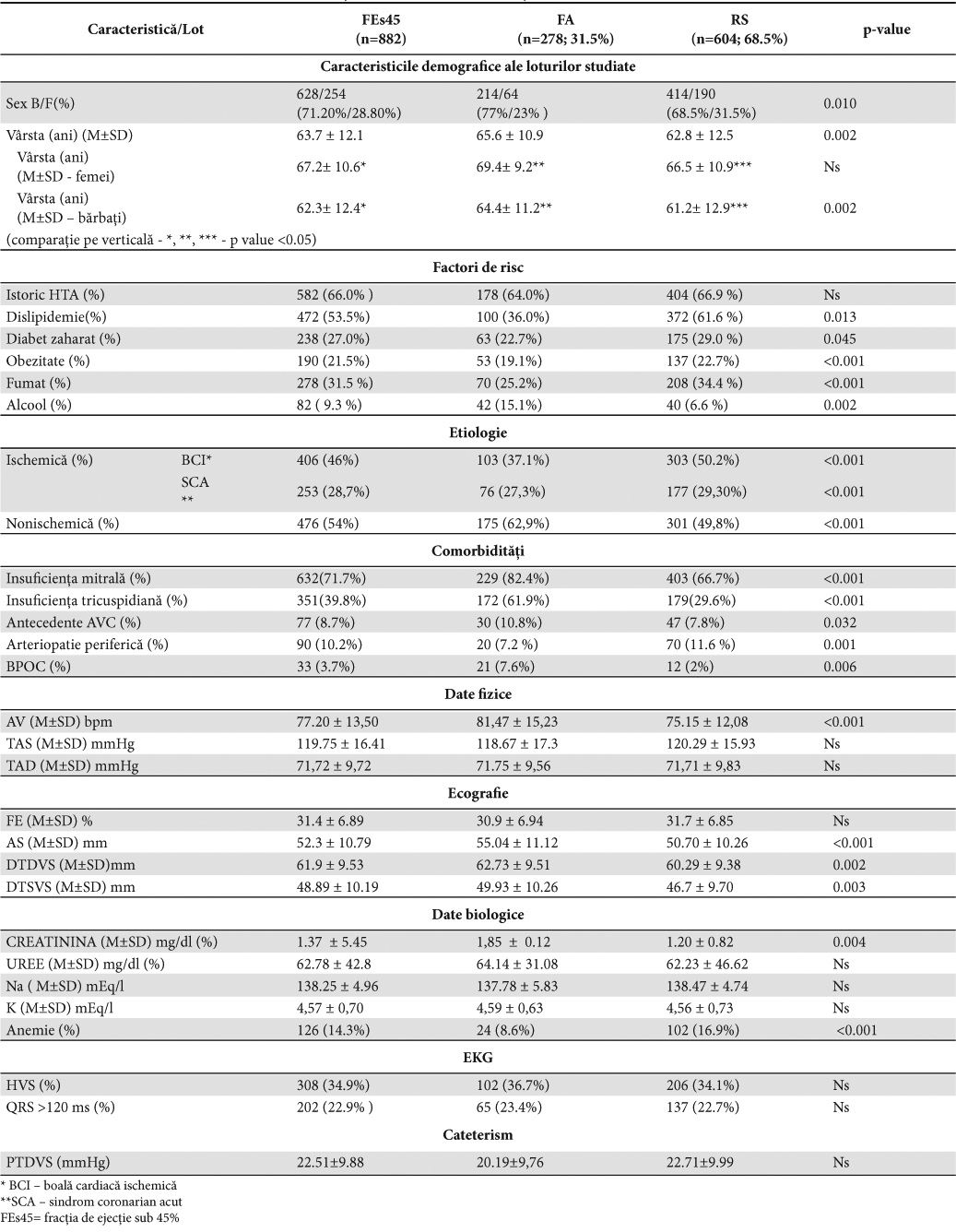
Structura pe sexe este dominată de cel masculin, atât la nivelul întregului lot (71,20% B vs 28,80% F) cât şi la nivelul subloturilor (77% B vs 23% F) FA, respectiv (68,5% B vs 31,5% F) RS (Figura 1). Vârsta medie a pacienţilor a fost de 63,7 ± 12,1 ani; vârsta pacienţilor în FA (65,6 ± 10,9 ani) a fost mai mare (p=0,002) decât a celor în RS (62,8 ± 12,5 ani); vârsta femeilor a fost mai mare atât la nivelul lotului global (67,2 ± 10,6 ani F vs 62,3 ± 12,4 ani B) cât şi la nivelul celor două subloturi (69,4 ± 9,2 ani F vs 64,4 ± 11,2 ani B) FA şi (66,5 ± 10,9 ani F vs 61,2 ±12,9 ani B) RS (p <0,05).
Au fost analizate caracteristicile clinice ale pacienţilor cu ICFES şi FA comparativ cu cele ale pacienţilor în RS.
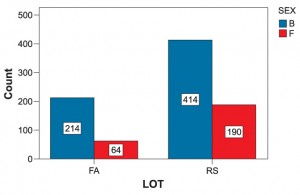
Figura 1. Distribuţia pe sexe şi subloturi de cercetare
Legenda:Count=frecvență subiecți; B-bărbaţi; F-femei; FA=lot în fibrilaţie atrială; RS=lot în ritm sinusal
Pacienţii cu FA au avut o etiologie dominant nonischemică (62,9% FA vs 49,8% RS; p <0,001), procentul mai mult decât dublu al consumatorilor de alcool (15,1% FA vs 6,6% RS; p=0,002) şi o frecvenţă mai mare a antecedentelor de AVC (10,8% FA vs 7,8% RS; p=0,032).
Prevalenţa factorilor de risc cardiovasculari este mai mare în sublotul în RS. Astfel, se consemnează diferenţe pentru dislipidemie (61,6 % RS vs 36,0 % FA; p= 0,013), obezitate (22,7% RS vs 19,1% FA; p <0,001), fumat (34,4% RS vs 25,2% FA; p <0,001). Prevalenţa diabetului zaharat (29,0 % RS vs 22,7% FA; p=0,045) şi a HTA (66,9% RS vs 64,0% FA; p >0,05) a fost apropiată în cele două subloturi, în cazul diabetului cu o diferenţă la limita semnificaţiei statistice în favoarea celor în RS.
La pacienţii cu FA s-a constatat o frecvenţă mai mare a insuficienţei mitrale (82,4% FA vs 66,7% RS; p <0,001) şi a celei tricuspidiene (61,9 % FA vs 29,6 % RS; p <0,001). BPOC-ul a fost mai frecvent întâlnit (7,6% FA vs 2% RS p=0,006), iar frecvenţa cardiacă la internare a fost mai mare (81,47 ± 15,23 bpm FA vs 75,15 ± 12,08 bpm RS; p <0,001).
Ecocardiografic s-a evidenţiat asocierea FA cu dilatarea AS (55,04 ± 11,12 mm FA vs 50,70 ± 10,26 mm RS; p<0.001), și cu valorile mai mari ale DTDVS (62,73 ± 9,51 mm FA vs 60,29 ± 9,38 mm RS; p=0,002) şi ale DTSVS (49,93± 10,26 mm FA vs 46,7 ± 9,70 mm RS; p=0,003).
FE a fost similară în cele două subloturi (30,9% ± 6,94 FA vs 31,7 % ± 6,85 RS).
În ceea ce priveşte probele biochimice, creatinina sanguină a avut valori mai mari la pacienţii în FA (1,85 ± 0.12 mg% FA vs 1,20 ± 0,82 mg % RS; p=0,004) în timp ce anemia a avut o frecvenţă de două ori mai mare la pacienţii în RS (16,9% RS vs 8,6% FA; p <0,001).
EKG-ul nu a arătat diferenţe în ceea ce priveşte HVS şi durata QRS între cele două subloturi. Presiunea telediastolică a ventriculului stâng (PTDVS) determinată prin cateterism cardiac a fost mai mare la pacienţii în RS (22,71±9,99 mmHg RS vs 20,19±9,76 mmHg FA).
Medicaţia prescrisă la externare
Tratamentul prescris la externare este detaliat în Tabelul 1B. Medicamentele cel mai frecvent prescrise la pacienţii din lotul global au fost betablocantele (BB) (87,1%) şi diureticele de ansă (86,3%).
Tabelul 1B. Tratamentul recomandat la externare
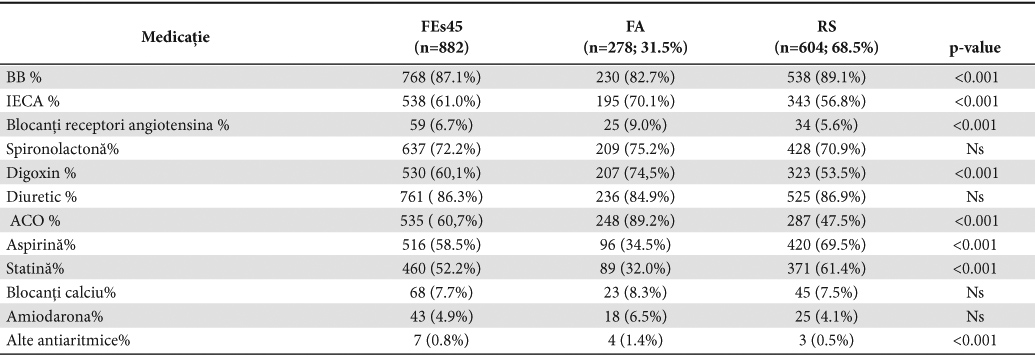
Aşa cum era de aşteptat, tratamentul a fost diferenţiat în funcţie de apartenenţa la unul din cele două subloturi. Astfel, la pacienţii în FA faţă de cei în RS s-a observat o utilizare mai mare a digoxinului (74,5% vs 53,5%), a anticoagulantelor orale ACO (89,2% vs 47,5%) şi a inhibitorilor enzimei de conversie a angiotensinei IECA (70,1% vs 56,8%). Pacienţii în RS au folosit mai mult BB (89,1% vs 82,7%), aspirina (69,5% vs 34,5%) şi statina (61,4% vs 32,0%); în toate aceste cazuri diferenţele înregistrate au avut înaltă semnificaţie statistică (p <0,001).
Administrarea diureticului de ansă (86,9% RS vs 84,9% FA), a spironolactonei (70,9%RS vs 75,2%FA) şi a amiodaronei (4,1% RS vs 6,5% FA), nu a variat între cele două subloturi (p >0,05).
Revascularizaţie miocardică intervenţională (angioplastie) s-a practicat la 74 pacienţi, revascularizarea chirurgicală doar la 9 pacienţi, reprezentând 18,23%, respectiv 2,22% din totalul pacienţilor diagnosticaţi cu boală cardiacă ischemică.
Rezultate privind supravieţuirea
La sfârşitul perioadei de urmărire, s-au înregistrat 366 de decedaţi (D) şi 516 de supravieţuitori (S); proporţia deceselor a fost mai mare la sublotul FA (47.5% FA vs 38.7% RS; p<0.05).
Influenţa FA în supravieţuirea pacienţilor cu ICFES a fost evaluată în etape succesive care au vizat profilul (demografic şi clinic) pacientului decedat şi ierarhia factorilor de prognostic.
Statistica descriptivă a evidenţiat diferenţe semnificative (p<0.05) între caracteristicile pacienţilor decedaţi şi cele ale pacienţilor rămaşi în viaţă în timpul perioadei de urmărire.
Pacientul decedat a fost mai frecvent de sex masculin (74% D vs 69% S p=0.017), mai vârstnic (64.9±12.8 ani D vs 62.8 ±11.6 ani S, p=0.013), cu valoarea FEVS mai mică (30.3% ± 7.14 D vs 32.2%±6.6 S, p = 0.026) şi cu frecvenţa mai mare a FA la internare (36% D vs 28% S, p= 0.022). S-au consemnat deosebiri şi în ceea ce priveşte factorii de risc şi comorbidităţile; astfel, pacienţii care au decedat au fost mai frecvent consumatori de alcool (12% D vs 7.6% S p<0.001), anemici (21% D vs 13.5% S, p<0.001), au asociat mai frecvent diabet zaharat (30.3% D vs 24.6 % S, p= 0.012), antecedente de AVC (9.6% D vs 8,1%S p= 0.031) şi BPOC (3,49 % vs 2,9 % p= 0.017).
Rezultatele orientează asupra unor primi factori (variabile) de analiză ca vârsta, FA, comorbidităţile consemnate ca fiind mai frecvente la pacienţii decedaţi.
Această primă etapă a fost completată cu analiza mortalităţii la distanţă, evaluată cu ajutorul următorilor parametri:
– ratele generale şi specifice de deces;
– curbele de supravieţuire Kaplan Meier;
– analiza multivariata prin modelului riscului proporţional Cox.
Rata generală a deceselor, calculată ca raport procentual al evenimetelor fatale în populaţia lotului global, a fost de 41.5%. Prezenţa FA creşte riscul de deces. Rata de deces în sublotul cu FA, superioară celui în RS (47.5% FA vs 38.7 0/0 RS; p=0.003), sugerează că ne putem aştepta ca din 2 bolnavi cu insuficienţă cardiacă cu fracţie de ejecţie scăzută şi FA, unul să înregistreze evenimentul fatal.
Asocierea FA cu excesul de mortalitate la distanţă este pusă în evidenţă şi prin analiza structurii mortalităţii în raport cu momentul luării în observaţie (To) şi intervalul scurs până la deces Ti, i={0÷5}. Astfel, încă din primul an de urmărire proporţia deceselor înregistrate la sublotul cu FA este mai mare decât în sublotul cu RS (42,4% sublot FA vs 35,5% sublot RS; p <0,05); 72,3% din decesele înregistrate în sublotul cu FA au loc în primii 2 ani de observaţie, în comparaţie cu doar 68,8% în sublotul cu RS (Figura 2).
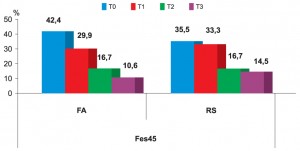
Figura 2. Frecvenţa anuală a deceselor la distanţă în raport de prezenţa FA şi de distanţa scursă de la includerea în studiu până la survenirea decesului
Legendă: Fes45= fracţia de ejecţie sub 45% ; FA-fibrilaţie atrială, RS=ritm sinusal ; T0=% decese în primul an; T1=% decese în al doilea an; T2= % decese în al treilea an ; T3= % decese în al patrulea şi al cincilea an.
Completarea evaluării cu analiza tabelelor de supravieţuire evidenţiază că FA a influenţat semnificativ proporţia cumulată a supravieţuitorilor; diferenţele se înregistrează încă din primele 3 luni de observaţie, proporţia celor aflaţi în viaţă în sublotul FA fiind inferioară celei înregistrate în sublotul RS ( 86.3% FA vs 90.4% RS); după 2 ani de la externare în sublotul cu RS mai erau în viaţă 69,2% dintre pacienţi în timp ce în sublotul cu FA supravieţuiau doar 60,7% dintre pacienţi; după 3 ani, conform frecvenţei cumulate de deces, în sublotul cu FA ar mai fi supravieţuit puţin peste jumătate din efectivul iniţial (Tabelul 2).
Tabelul 2. Proporţia cumulată a supravieţuitorilor în raport de prezenţa FA
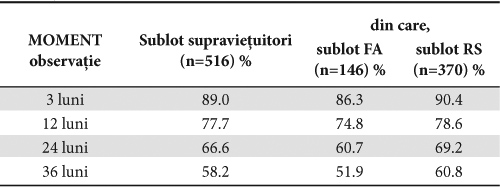
Un plus de informaţie în validarea influenţei FA asupra supravieţuirii a fost adus de calculul duratei de supravieţuire şi compararea acesteia între subloturi prin aplicarea testului log-rank. La nivelul lotului global se estimează o durată mediană de viaţă de 1254.4 zile (95% CI 1199.31-1309.58); durata mediană de supravieţuire estimată în sublotul în FA a fost de 1140 zile (95% CI 1042.59 – 1237.68) inferioară celei calculate în sublotul în RS, de 1302 zile (95% CI 1235.98 – 1367.64) (log-rank p-value=0,011).
Curbele Kaplan-Meier redau sugestiv şansa de supravieţuire care este mai mică în sublotul cu FA. Log-rank-testul confirmă probabilitatea de supravieţuire semnificativ mai scăzută pentru aceşti pacienţi (p=0,011) (Figura 3).
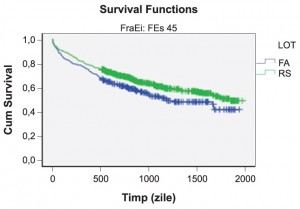
Figura 3. Curbele de supravieţuire (Kaplan –Meier) în raport de prezenţa fibrilaţiei atriale (log-rank p-value=0.011).
Construirea curbelor Kaplan–Meier şi aplicarea log-rank testului pentru evidenţierea diferenţelor de supravieţuire a diverselor grupuri, reprezintă un prim pas al analizei univariate. Variabilele supuse analizei sunt cele sugerate de profilul pacientului decedat şi ratele specifice de deces.
Durata supravieţuirii fiind însă rezultanta unui complex de factori s-a completat evaluarea cu analiza riscului proporţional (modelul Cox) care sugerează care dintre elementele clinice sau paraclinice ce caracterizau profilul pacienţilor influenţează supravieţuirea acestora.
Analiza multivariată prin modelul riscului proporţional Cox a identificat factorii de prognostic ai mortalităţii pentru pacienţii cu ICFES.
Aplicarea regresiei hazardului proporţional (regresia Cox) pentru pacienţii cu ICFES a permis ierarhizarea factorilor predictivi independenţi asociaţi cu mortalitatea de orice cauză la distanţă. Modelul a selecţionat factorii de prognostic: favorabil, când HR<1; defavorabil, când HR >1.
În Tabelul 3 prezentăm factorii independenţi de prognostic ai mortalităţii identificaţi de analiza multivariată pentru lotul cu ICFES.
Tabelul 3. Factorii de prognostic asociaţi cu mortalitatea pacienţilor cu ICFES
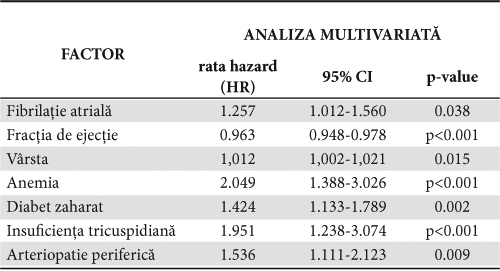
FA este factor de prognostic negativ, fiind responsabilă de creşterea riscului de deces cu 14% la analiza univariată (HR: 1.147 95% CI 1.031-1.277; p=0.012). respectiv cu 25,7% la analiza multivariată (HR: 1.257; 95% CI1.012-1.560; p=0.038). FE scăzută are valoare de prognostic negativ; îmbunătăţirea acesteia cu o unitate determină reducerea semnificativă a riscului cu cca 3% (HR: 0.963; 95% CI 0.948-0.978; p<0.001). În ceea ce priveşte vârsta, cu fiecare an de vârstă, riscul de deces creşte cu cca 1,2% (HR: 1. 012; 95%CI 1,002 – 1,021; p=0.015). Alţi factori cu valoare prognostică negativă sunt: anemia (HR: 2.049; 95%CI 1.388 – 3.026; p<0.001), diabetul zaharat (HR: 1.424; 95% CI 1.133 – 1.789; p=0.002), insuficienţa tricuspidiană (HR:1.951; 95% CI 1.238 – 3.074 ; p<0.001) şi arteriopatia periferică (HR:1.536; 95% CI 1.111 – 2.123; p=0.009).
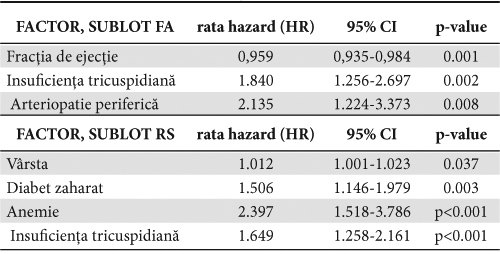
În Tabelul 4 sunt prezentaţi factorii independenţi de prognostic ai mortalităţii pe subloturi:
– pentru sublotul în FA: FE (HR-0,959; 95%CI 0,935-0,984; p=0.001), insuficienţa tricuspidiană (HR -1.840; 95% CI 1.256-2.697; p=0.002) şi arteriopatia periferică (HR : 2.135; 95% CI 1.224-3.373; p=0.008).
– pentru sublotul în RS: vârsta (HR-1.012; 95% CI 1.001-1.023; p=0.037), diabetul zaharat, (HR-1.506; 95% CI 1.146-1.979; p=0.003), anemia (HR-2.397; 95% CI 1.518-3.786; p<0.001) şi insuficienţa tricuspidiană (HR 1.649; 95% CI 1.258-2.161; p<0.001).
Tabelul 4. Factori independenţi asociaţi cu mortalitatea pacienţilor cu ICFES, în raport de prezenţa FA (analiza multivariată)
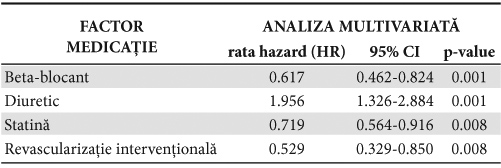
În raport cu terapia medicamentoasă recomandată la externare, analiza multivariată a consemnat că, pentru lotul global, prognosticul pozitiv s-a asociat cu administrarea BB (HR:0.617; 95% CI 0.462-0.824; p<0.001) şi a statinei (HR 0.719; 95% CI 0.564-0.916; p=0.008). Reţinem ca factor predictiv pozitiv şi revascularizaţia intervenţională (HR 0.529 95% CI0.329-0.850; p=0.008), nu şi cea chirurgicală (Tabelul 5).
Tabelul 5. Analiza multivariată între medicaţia la externare şi mortalitatea la lotul ICFES
Când analiza acestor variabile se face în raport cu prezenţa FA, prognosticul pozitiv s-a asociat cu administrarea de BB (HR 0.575; 95%CI 0.359-0.918; p=0.021) în timp ce pentru sublotul în RS s-a asociat cu administrarea IECA (HR 0.581; 95%CI 0.341~0.988; p=0.005) şi a statinei (HR 0.641; 95%CI 0.472-0.871; p=0.004) (Tabelul 6).
Tabelul 6. Analiza multivariată între medicaţia la externare şi mortalitatea la subloturi ICFES -FA şi ICFES -RS
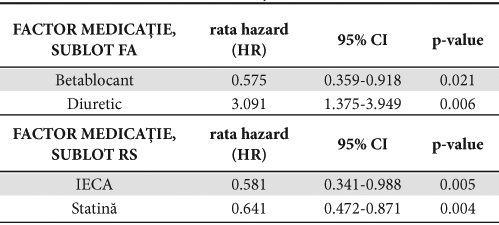
Diureticul de ansă se asociază cu un risc crescut de mortalitate atât pentru lotul global (HR1.956; 95%CI 1.326-2.884; p=0.001) cât şi pentru sublotul cu FA (HR 3.091; 95% CI 1.375-3.949; p=0.006) (Tabele 5, 6). Acest fapt ar putea fi explicat parţial prin gravitatea bolii acestor pacienţi; FEVS a fost semnificativ mai scazută la pacienţii decedaţi care au luat diuretic decât la supravieţuitorii care au luat diuretic (30.2% D vs 32.2% S, p<0.001).
DISCUŢII
Analiza retrospectivă a 882 pacienţi spitalizaţi consecutiv pentru ICFES în clasele funcţionale III şi IV NYHA a arătat coexistenţa fibrilaţiei atriale şi a insuficienţei cardiace la un număr mare de pacienţi, FA la includerea în studiu fiind consemnată la aproape o treime dintre aceştia.
Prevalenţa FA
Studii clinice anterioare, cum ar fi VAILANT (14660 pacienţi incluşi, 2151 în FA)5, COMET (3029 pacienţi incluşi, 600 în FA)6, CHARM (3941 pacienţi incluşi 670 în FA)7, EHF( 3675 pacienţi incluşi, 827 în FA)8, au raportat o prevalenţă a FA la pacienţii cu ICFES care a variat între 14.5% şi 23%. Studiul nostru, cu o prevalenţă a FA mult mai mare (31.5%), se apropie din acest punct de vedere de substudiul COACH9, unde prevalenţa a fost de 35%. Ambele studii au inclus pacienţi cu ICFES moderat-severă. Procente asemănătoare au fost constatate şi în alte studii în care s-a văzut că prevalenţa FA creşte odată cu vârsta şi severitatea IC10-13.
Valoarea prognostică a FA la pacienţii cu ICFES
Asocierea celor două sindroame, FA şi IC, este frecvent întâlnită în practică, fără a se şti exact care este influenţa aritmiei asupra evoluţiei IC.
Mecanismele prin care FA ar putea influenţa evoluţia negativă a pacienţilor cu ICFES sunt complexe: FA, prin ritmul ventricular neregulat, cel mai adesea rapid, pierderea contracţiei atriale, pierderea secvenţialităţii atrioventriculare, creşterea regurgitărilor mitrale şi tricuspidiene urmate de scăderea debitului cardiac şi creşterea presiunilor de umplere, pot determina sau agrava ICFES14-17bis.
Studiile clinice efectuate până în prezent au raportat rezultate contradictorii; unele studii au arătat că prezenţa FA la înrolare nu a fost asociată cu creşterea mortalităţii18-20, în timp ce altele au constatat că FA este asociată independent cu un exces de mortalitate21-24.
Rezultatele studiului nostru susţin această ultimă idee, punând în evidenţă asocierea independentă dintre FA diagnosticată la înrolare şi mortalitatea ridicată pe termen lung la pacienţii cu ICFES: rata mortalităţii pacienţilor în FA a fost semnificativ mai mare decât a celor în RS; analiza multivariată a desemnat FA ca factor independent asociat cu creşterea mortalităţii de toate cauzele.
Datele noastre sunt în concordanţă cu rezultatele studiilor DIAMOND21, CHARM23, SOLVD24, VALIANT5 şi cel a lui Grigorian Shamagian et al.22.
La pacienţii cu valori mai scăzute ale fracţiei de ejecţie s-a constatat o situaţie diferită. Astfel, la subiecţii cu FEVS <25%, analiza multivariată nu a arătat o diferenţă semnificativă între mortalitatea pacienţilor cu FA la înrolare comparativ cu cea a pacienţilor în RS, FA nemaifiind un predictor independent al mortalităţii pe termen lung. Rezultate asemănătoare au fost raportate de autorii studiilor care au inclus doar pacienţi cu disfuncţie sistolică severă25-28.
Datele de mai sus sugerează că FA este factor de prognostic negativ la pacienţii cu ICFES, dar că efectul independent al aritmiei asupra mortalităţii este invers proporţional cu severitatea IC.
O explicaţie a acestei relaţii ar putea fi aceea că, la pacienţii cu IC cu FEVS foarte scăzută, prognosticul este dictat în primul rând de severitatea IC şi nu de consecinţele negative ale FA, aşa cum se întâmplă de regulă la pacienţii cu funcţie VS moderat afectată.
Mecanismele fiziopatologice care ar putea explica acest comportament sunt următoarele:
1) pierderea sistolei atriale; studii anterioare au arătat că la pacienţii cu IC severă, spre deosebire de cei cu IC uşoară/ moderată, disfuncţia sistolică avansată a VS se însoţeşte cu disfuncţia diastolică severă cu pattern restrictiv, sugerând că instalarea/prezenţa FA pare să aibă consecinţe hemodinamice mai mici;
2) ritmul cardiac neregulat; studii mai vechi au arătat că gradul de neregularitate scade odată cu severitatea IC datorită activării neurohormonale progresive, sugerându-se astfel că FA are un impact hemodinamic mai mare la pacienţii cu IC mai puţin severă;
3) rolul antiaritmicelor; acestea pot agrava disfuncţia cardiacă din cauza efectului inotrop negativ; în plus, prin efectul proaritmic, frecvenţa morţii subite creşte9,26.
Din această perspectivă s-ar putea explica şi discordanţele dintre rezultatele diverselor studii pe această temă. Astfel, rezultatele studiilor lui Mahoney et al., Crijns et al, Mustafa I et al.18-20 care au inclus pacienţi cu IC foarte severă şi care au constatat că FA nu este un predictor independent al mortalităţii, sunt la fel de justificate ca şi cele ale lui Olsson et al., Dries et al23,24 care au inclus în studiile lor pacienţi cu IC mai puţin severă şi care au raportat că FA este un predictor independent al mortalităţii crescute.
Analiza tuturor acestor rezultate sugerează că FA pare a avea un impact mai mic asupra prognosticului pacienţilor cu insuficienţă cardiacă severă în timp ce la pacienţii cu IC moderat/severă, prezenţa FA aduce cu sine un exces de mortalitate care se adaugă la riscul intrinsec al IC.
LIMITELE STUDIULUI
– Fiind un studiu retrospectiv, designul a fost impus de ‘trecut’ cu constrângerile sale materiale (exemplu: lipsa determinării sistematice a peptizilor natriuretici) sau cu lipsa unor date în evaluarea pacienţilor.
– Dificultăţile unui follow-up prin corespondenţa cu pacientul/medicul de familie, a condus la precaritatea recoltării unor date importante (exemplu: respitalizările pentru agravarea IC, apariţia complicaţiilor embolice, necunoaşterea modificărilor schemelor de tratament făcute în teritoriu).
– Nu s-a putut aprecia frecvenţa FA nou apărute şi impactul prognostic al acesteia la pacienţii cu ICFES.
– Lipsa surselor de informare asupra mortalităţii de cauză cardiovasculară.
CONCLUZII
– Studiul nostru a evidenţiat o prevalenţă crescută a FA, de 31.5% la populaţia de pacienţi cu ICFES.
– Pacienţii cu ICFES şi FA faţă de cei în RS au fost mai vârstnici, majoritatea bărbaţi şi au avut multiple comorbidităţi.
– FA s-a dovedit a fi un factor independent de prognostic pentru excesul de mortalitate de toate cauzele la pacienţii cu IC moderat/ severă şi FE scăzută.
– La pacienţii cu IC şi FE <25%, FA încetează să mai fie factor independent de prognostic pentru mortalitate.
– Deoarece datele din literatură sunt contradictorii iar comparaţia între rezultatele diverselor studii este dificilă datorită heterogenităţii lor, sunt necesare noi studii care să includă un număr mai mare de pacienţi, cu perioade mai lungi de urmărire şi care să fie concepute special pentru a arăta rolul FA în evoluţia pacienţilor cu ICFES.
Conflict de interes: niciunul.
Bibliografie
1. Braunwald E, Shattuck Lecture: cardiovascular medicine at the turn of the millennium: triumphs, concerns, and opportunites. N Engl J Med 1997;337;1360-9
2. Leonida Gherasim, Adriana Ilieşiu; Fibrilaţia atrială şi insuficienţa cardiacă: aspecte demografice, patofiziologice şi opţiuni terapeutice Revista Română de Cardiologie 2007; 4:340-348.
3. Maisel WH, Stevenson LW. Atrial fibrillation in heart failure: epidemiology, pathophysiology, and rationale for therapy. Am J Cardiol 2003;91:2D–8D.
4. Stevenson WG, Stevenson LW, Middlekauff HR, et al. Improving survival for patients with atrial fibrillation and advanced heart failure. J Am Coll Cardiol 1996; 28:1458-63
5. Lars Køber, Karl Swedberg , John J.V. McMurray, Marc A. Pfeffer, Eric J. Velazquez, Rafael Diaz, Aldo P. Maggioni, Viatcheslav Mareev, Grzegorz Opolski, Frans Van de Werf, Faiez Zannad, Georg Ertl, Scott D. Solomon, Steven Zelenkofske, Jean-Lucien Rouleau, Jeffrey D. Leimberger, Robert M. Califf . Previously known and newly diagnosed atrial fibrillation: A major risk indicator after a myocardial infarction complicated by heart failure or left ventricular dysfunction. European Journal of Heart Failure 8 (2006) 591-598
6. Swedberg K, Olsson LG, Charlesworth A, Cleland J, Hanrath P, Komajda M, Metra M, Torp-Pedersen C, Poole-Wilson P. Prognostic relevance of atrial fibrillation in patients with chronic heart failure on long-term treatment with betablockers: results from COMET. Eur Heart J 2005;26:1303–1308.
7. PfefferMA, Swedberg K, Granger CB, Held P,McMurray JJ, Michelson EL, et al. Effects of candesartan on mortality and morbidity in patients with chronic heart failure: the CHARM-Overall programme. Lancet 2003;362:759–66.
8. Lenzen MJ, Scholten OP, Reimer WJM, Boersma E, Vantrimpont PJMJ, Follath F, Swedberg K, Cleland J, Komajda M. Differences between patients with preserved and a depressed left ventricular function: a report from the EuroHeart Failure Survey. Eur Heart J 2004;
25:1214–1220.
9. Gerard C.M. Linssen, Michiel Rienstra, Tiny Jaarsma, Adriaan A. Voors, Isabelle C. van Gelder, Hans L. Hillege, and Dirk J. van Veldhuisen Clinical and prognostic effects of atrial fibrillation in heart failure patients with reduced andpreserved left ventricular ejection fraction European Journal of Heart Failure June 3, 2011
10. Benjamin EJ, Wolf PA, D’Agostino RB, Silbershatz H, Kannel WB, Levy D. Impact of atrial fibrillation on the risk of death: the Framingham Heart Study. Circulation 1998;98:946–952.
11. Joglar JA, Acusta AP, Shusterman NH, et al. Effect of carvedilol on survival and hemodynamics in patients with atrial fibrillation and left ventricular dysfunction: retrospective analysis of the US Carvedilol Heart Failure Trials Program. Am Heart J 2001; 142:498-501.
12. Veldhuisen DJ, Aass H, El Allaf D, Dunselman PH, Gullestad L, Halinen M, Kjekshus J, Ohlsson L, Wedel H, Wikstrand J; MERIT-HF Study Group. Presence and development of atrial fibrillation in chronic heart failure. Experiences from the MERIT-HF Study. Eur J Heart Fail 2006;8:539–546.
13. Anter E, Jessup M, Callans DJ. Atrial fibrillation and heart failure: treatment consideratons for a dual epidemic. Circulation 2009;119: 2516–2525
14. Cezar Macarie, Ileana Ţepeş Piser. Current management of atrial fibrillation in the heart failure. Revista Societăţii de Medicină Internă 2011;4:29-40
15. Neuberger HR, Mewis C, van Veldhuisen DJ, Schotten U, van Gelder IC, Allessie MA, Böhm M. Management of atrial fibrillation in patients with heart failure. Eur Heart J 2007;28:2568–2577.
16. Roy D, Talajic M, Nattel S, Wyse DG, Dorian P, Lee KL, Bourassa MG, Arnold JM, Buxton AE, Camm AJ, Connolly SJ, Dubuc M, Ducharme A, Guerra PG, Hohnloser SH, Lambert J, Le Heuzey JY, O’Hara G, Pedersen OD, Rouleau JL, Singh BN, Stevenson LW, Stevenson WG, Thibault B, Waldo AL; Atrial Fibrillation and Congestive Heart Failure Investigators. Rhythm control versus rate control for atrial fibrillation and heart failure. New Engl J Med 2008;358: 2667–2677.
17. Mariana Floria, Cătălina Georgescu Arsenescu. Remodelarea structurală atrială în fibrilaţia atrială: cauză sau efect? Revista Română de Cardiologie 2010;25:22-28
17bis. Steven A. Lubitz, Emelia J. Benjamin, and Patrick T. Ellinor, Published in final edited form as: Atrial Fibrillation in Congestive Heart Failure Heart Fail Clin. 2010 April; 6(2): 187–200.
18. Mahoney P, Kimmel S, DeNofrio D, Wahl P, Loh E. Prognostic significance of atrial fibrillation in patients at a tertiary medical center referred for heart transplantation because of severe heart failure. Am J Cardiol 1999;83:1544–1547
19. Crijns HJ, Tjeerdsma G, de Kam PJ, Boomsma F, Van GI, van den Berg MP, et al. Prognostic value of the presence and development of atrial fibrillation in patients with advanced chronic heart failure. Eur Heart J 2000;21(15):1238–45.
20. Mustafa I. Ahmed, Michel White, O. James Ekundayo, Thomas E. Love, Inmaculada Aban, Bo Liu, Wilbert S. Aronow, and Ali Ahmed. A history of atrial fibrillation and outcomesn in chronic advanced systolic heart failure: a propensity-matched study. European Heart Journal (2009) 30, 2029–2037
21. Pedersen OD, Bagger H, Keller N, et al.; for the Danish Investigations of Arrhythmia and Mortality ON Dofetilide Study Group. Efficacy of dofetilide in the treatment of atrial fibrillation–flutter in patients with reduced left ventricular function: a Danish Investigations of Arrhythmia and Mortality ON Dofetilide (DIAMOND) Substudy. Circulation 2001;104:292-296
22. Grigorian Shamagian L, Roman AV, Seara JG, Sande JL, Veloso PR, Gonzalez-Juanatey JR. Atrial fibrillation in patients hospitalized for congestive heart failure: the same prognostic influence independently of left ventricular systolic function. Int J Cardiol 2006;110:366–72
23. Olsson LG, Swedberg K, Ducharme A, et al. Atrial fibrillation and risk of clinical events in chronic heart failure with and without left ventricular systolic dysfunction: results from the Candesartan in Heart failure-Assessment of Reduction in Mortality and morbidity (CHARM) program. J Am Coll Cardiol 2006; 47:1997.-2006
24. Dries DL, Exner DV, Gersh BJ, Domanski MJ, Waclawiw MA, Stevenson LW. Atrial fibrillation is associated with an increased riskfor mortality and heart failure progression in patients with asymptomatic and symptomatic left ventricular systolic dysfunction: a retrospective analysis of the SOLVD trials. Studies of Left Ventricular Dysfunction. J Am Coll Cardiol 1998;32:695–703.
25. Middlekauff HR, Stevenson WG, Stevenson LW. Prognostic significance of atrial fibrillation in advanced heart failure. A study of 390 patients. Circulation 1991; 84:40–48
26. van den Berg MP, van Gelder IC, van Veldhuisen DJ. Impact of atrial fibrillation on mortality in patients with chronic heart failure. Eur J Heart Fail 2002;4:571–575.
27. Pedersen OD, Bagger H, Kober L, Torp-Pedersen C. Impact of congestive heart failure and left ventricular systolic function on the prognostic significance of atrial fibrillation and atrial flutter following acute myocardial infarction. Int J Cardiol 2005;100:65–71.
28. Pernille Corell, Finn Gustafsson, Morten Schou, John Markenvard, Tonny Nielsen, Per Hildebrandt Prevalence and prognostic significance of atrial fibrillation in outpatients with heart failure due to left ventricular systolic dysfunction European Journal of Heart Failure 9 (2007) 258–265
 This work is licensed under a
This work is licensed under a